ARTICLE
독일가문비 묘목에 모잘록병을 유발하는 Fusarium oxysporum에 대한 Bacillus velezensis CE 100의 생물학적 방제 효과
Biocontrol of Bacillus velezensis CE 100 against Fusarium oxysporum Causing Damping-off in Picea abies (L.) Karst. Seedling
Su-Yeon Lee1
,
Su-In Choi1
,
Young Sang Ahn1,*
Author Information & Copyright ▼
1Department of Forest Resources, College of Agriculture and Life Sciences, Chonnam National University, Gwangju, Korea
*Corresponding author : Young Sang Ahn, Department of Forest Resources, College of Agriculture and Life Sciences, Chonnam National University, Gwangju, Korea, Tel : +82-62-530-2081, E-mail :
ysahn@jnu.ac.kr
© Copyright 2023, Institute of Agricultural Science & Technology, Chonnam National University. This is an Open-Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Received: Dec 04, 2023 ; Revised: Dec 15, 2023 ; Accepted: Dec 21, 2023
Published Online: Dec 31, 2023
Abstract
Norway spruce (Picea abies (L.) Karst.) is a desirable coniferous species for afforestation due to its ecological adaptability and high economic value. However, the production of high-quality seedlings required for successful afforestation is often constrained by fungal pathogens, which lower the survival and growth vigor of P. abies seedlings. Nurseries mainly use chemical pesticides to control fungal pathogens, but their negative effects on the environment, and the emergence of resistant pathogenic strains necessitate the development of biological control alternatives. This study investigated the biocontrol effect of Bacillus velezensis CE 100 against fungal pathogen that cause seedling damping off in P. abies forest nursery. A fungal strain was isolated from P. abies seedlings exhibiting damping off symptoms and the strain was identified as Fusarium oxysporum. Bacillus velezensis CE 100 showed strong antifungal properties through the production of lytic enzymes such as chitinase, β-1,3-glucanase, and protease during bacterial growth, with a maximum activity of 97.79 unit/mL, 11.95 unit/mL, and 21.26 unit/mL, respectively. Treatment with the bacterial crude enzyme fraction at a concentration of 100 μL/mL hydrolyzed the fungal cell wall and consequently inhibited the spore germination and mycelial growth of F. oxysporum by 95.24% and 42.50%, respectively. These results demonstrate that B. velezensis CE 100 can contribute to the production of high-quality P. abies seedlings by controlling F. oxysporum.
Keywords: plant growth-promoting bacteria; biocontrol; fungal disease; lytic enzymes; seedling production
서 론
독일가문비(Picea abies (L.) Karst.)는 북유럽의 아한대 산림 및 알프스산맥과 카르파티아산맥의 아고산 지역에 자연분포하는 소나무과 가문비나무속의 상록 교목으로, 빠른 생장과 좋은 품질로 경제적 가치가 높아 18세기부터 유럽을 중심으로 식재되었다[1–4]. 또한 독일가문비는 생태적 적응성이 좋아 산악지역뿐 아니라 다양한 환경조건에서 적응하여 생장할 수 있어 미국, 캐나다, 일본, 남아프리카, 호주 및 뉴질랜드 등 다양한 국가에서 식재되고 있다[1,2].
독일가문비는 대표적인 조림수종이지만, 양묘장에서 발생하는 곰팡이병으로 건전묘목 생산이 저해되고 있다[5]. 특히 Fusarium spp.는 전 세계적으로 양묘장에 흔히 발생하는 곰팡이병 병원균으로, 독일가문비와 같은 침엽수에 모잘록병 및 뿌리썩음병을 발생시켜 피해를 유발하는 것으로 알려져 있다[6,7]. 본 연구에서도 Fusarium oxysporum에 의한 모잘록병으로 독일가문비 묘목이 고사하는 피해가 발생하였다. F. oxysporum은 토양을 통해 전반되어 수목의 물관부에 침입하며, 발아 및 균사체 생장을 통해 물관을 막아 묘목에 시들음과 고사를 발생시킨다[8–10]. 그러므로 건전한 독일가문비 묘목 생산을 위해 양묘장 내 F. oxysporum과 같은 곰팡이병 병원균의 방제가 중요하다. 그러나 우리나라의 독일가문비 양묘장에서는 묘목에 피해를 주는 곰팡이병 병원균에 관한 정보가 거의 없는 실정이다.
일반적으로 양묘장에서 곰팡이병 방제를 위해 합성농약인 살균제가 사용되고 있다[11]. 그러나 화학약제를 지속적으로 사용할 경우 수질오염과 토양오염 등의 환경문제가 발생하고, 화학약제에 저항성을 지닌 강력한 병원균이 출현하여 병원균 방제가 어려워지는 문제점이 있다[12–14]. 그래서 최근 살균제를 대체하여 묘목의 곰팡이병 방제를 위한 생물학적 방법이 주목받고 있다. 대표적으로 식물성장촉진박테리아(plant growth promoting bacteria, PGPB)인 Bacillus spp.가 많이 사용되고 있다[15–20]. Bacillus spp.는 키틴분해효소, β-1,3-글루칸분해효소 및 단백질분해효소와 같은 용균효소를 생성하여 키틴, β-1,3-글루칸 및 단백질 중합체로 구성된 곰팡이병 병원균의 세포벽을 분해하고 곰팡이병 병원균의 포자 발아와 균사 생장을 억제한다[15,19,21,22]. 이를 통해 Bacillus spp.는 양묘장에서 곰팡이병 발생을 감소시키고 묘목의 생존을 개선시킨다[15,16]. 그러나 우리나라의 양묘장에서 묘목에 피해를 주는 곰팡이병의 억제를 위해 식물성장촉진박테리아를 활용한 사례는 매우 적다[16,17]. 따라서 본 연구는 우리나라의 독일가문비 묘목에 피해를 주는 곰팡이병 병원균에 대한 부족한 정보를 제공하기 위해 고사한 묘목에서 곰팡이병 병원균을 분리 및 동정하였다. 또한 식물성장촉진박테리아인 Bacillus velezensis CE 100을 사용하여 독일가문비 양묘 시 발생하는 곰팡이병 병원균인 F. oxysporum을 방제하는 기작을 구명하고자 한다.
재료 및 방법
1. 독일가문비 묘목에 발생하는 곰팡이병 병원균 분리 및 동정
독일가문비 묘목 실험은 전남대학교 수목원(광주광역시 북구 용봉로 77)에 위치한 비닐하우스에서 수행하였다. 본 연구에 사용된 독일가문비는 2022년 7월에 국립산림품종관리센터에서 종자를 분양받았고, 흐르는 물에 1주일간 침지하고 파종하였다. 파종한 종자는 2022년 8월부터 발아하기 시작하였고, 2023년 5월부터 묘목의 줄기가 물러지면서 고사하는 개체가 발생하였다.
독일가문비 묘목에서 발생하는 곰팡이병 병원균을 분리하기 위해 고사한 묘목의 줄기를 1 cm 단위로 잘라 NaOCl 1% 용액과 에탄올 70% 용액으로 표면 소독한 후 증류수로 세척하고 건조하였다. 건조한 줄기 시료는 항생제(streptomycin 0.05 g/L)를 첨가한 PDA 배지(potato dextrose broth 24 g/L 및 agar 20 g/L)에 올려 25℃에서 배양하였다. 이후 곰팡이병 병원균의 순수 분리를 위해 항생제를 첨가하지 않은 PDA 배지에 계대배양하였다.
순수 분리된 곰팡이병 병원균의 동정은 Macrogen(Korea)에서 Internal transcribed spacer(ITS) 영역의 유전자 증폭 및 서열분석을 통해 수행되었다. 유전자 증폭과 서열분석에는 universal primer를 사용하였다(Table 1). 고사한 묘목에서 분리한 곰팡이병 병원균의 유전자 염기서열을 national center for biotechnology information(NCBI)의 basic local alignment and search tool (BLAST, http://www.ncbi.nlm.nih.gov/) 프로그램을 통해 다른 곰팡이 균주의 염기서열과 비교하여 분리된 곰팡이병 병원균과 reference 균주들 사이의 유사도를 분석하였다.
Table 1.
The universal primers used for ITS region amplification and sequencing
| Primer |
Primer sequence (5'-3') |
| ITS5 |
TCCGTAGGTGAACCTGCGG |
| ITS4 |
TCCTCCGCTTATTGATATGC |
Download Excel Table
2. B. velezensis CE 100의 준비 및 생장 패턴 분석
본 연구에 사용된 B. velezensis CE 100은 토마토를 재배하던 화분 토양에서 분리되었다[23]. B. velezensis CE 100 균주의 단일 콜로니를 TSB 배지(tryptone soy broth 30 g/L) 100 mL에 접종하고 30℃의 120 rpm 조건에서 2일간 배양하였다.
B. velezensis CE 100의 생장 패턴을 관찰하기 위해 PB 배지(pink fertilizer 3 g/L, KH2PO4 0.2 g/L, MgSO4 0.2 g/L, NaCl 0.1 g/L, CaCO3 0.1 g/L, sucrose 3 g/L, chitin powder 0.6 g/L, yeast extract 0.6 g/L, gelatin 0.024 g/L 및 power chitin 2 mL/L)에 B. velezensis CE 100의 배양액 1 mL/L를 접종하고 30℃의 120 rpm 조건에서 배양하였다. 접종 후 10일 동안 매일 희석한 배양액 100 μL를 TSA 배지(tryptone soy broth 30 g/L 및 agar 20 g/L)에 도말하여 30℃에서 배양하고 집락형성수(colony-forming unit, CFU)를 조사하였다. 실험은 3번 반복 수행되었다.
3. B. velezensis CE 100의 용균효소 활성
B. velezensis CE 100이 생성하는 용균효소인 키틴분해효소, β-1,3-글루칸분해효소 및 단백질분해효소의 활성을 분석하기 위해 PB 배지에 B. velezensis CE 100의 배양액 1 mL/L를 접종하고 30℃의 120 rpm 조건에서 배양하였다. 이후 10일 동안 매일 900 μL의 배양액을 채취하여 4℃의 12,000 rpm 조건에서 10분간 원심분리하여 상층액을 얻었다.
키틴분해효소 활성을 분석하기 위해 원심분리하여 얻은 배양액의 상층액 50 μL와 50 mM sodium acetate buffer(pH 5.0) 450 μL 및 0.5% colloidal chitin 500 μL를 혼합한 후 37℃에서 1시간 동안 반응시켰다. 그리고 1 N NaOH 200 μL를 넣어 반응을 정지시키고, 4℃의 12,000 rpm 조건에서 15분간 원심분리하여 혼합물의 상층액을 얻었다. 혼합물의 상층액 750 μL와 3차 증류수 250 μL 및 Schales reagent 1 mL를 혼합하고 100℃에서 15분간 끓였다. 키틴분해효소의 활성도는 UV 분광광도계(OPTIZEN Alpha, K LAB Corporation, Korea)를 사용하여 530 nm에서 흡광도를 측정하였다. 키틴분해효소 활성의 단위(unit/mL)는 37℃에서 1시간 동안 GlcNAc 1 μmol을 방출한 효소의 양으로 하였다.
β-1,3-글루칸분해효소 활성을 분석하기 위해 원심분리하여 얻은 배양액의 상층액 50 μL와 50 mM sodium acetate buffer 400 μL 및 0.01% laminarim 용액 50 μL를 혼합한 후 37℃에서 1시간 동안 반응시켰다. 그리고 dinitro salicylic acid solution 1.5 mL를 넣어 반응을 정지시키고 100℃에서 5분간 끓였다. β-1,3-글루칸분해효소 활성도는 UV 분광광도계를 사용하여 550 nm에서 흡광도를 측정하였다. β-1,3-글루칸분해효소 활성의 단위(unit/mL)는 37℃에서 1시간 동안 glucose 1 μmol을 방출한 효소의 양으로 하였다.
단백질분해효소 활성을 분석하기 위해 원심분리하여 얻은 배양액의 상층액 50 μL와 tris-HCl buffer(pH 8.0) 950 μL를 혼합한 후 60℃에서 15분 동안 반응시켰다. 그리고 20% trichloroacetic acid 500 μL를 넣어 반응을 정지시키고 15분간 상온에 두었다. 이후 4℃의 12,000 rpm 조건에서 15분간 원심분리하여 상층액을 얻고 UV 분광광도계를 사용하여 280 nm에서 흡광도를 측정하였다. 단백질분해효소 활성의 단위(unit/mL)는 1시간 동안 60℃에서 tyrosine 1 μg을 방출한 효소의 양으로 하였다. 모든 용균효소 실험은 3번 반복 수행되었다.
4. B. velezensis CE 100의 조효소 추출
조효소 추출을 위해 B. velezensis CE 100을 PB 배지에 접종하여 30℃의 120 rpm 조건에서 7일간 배양하였다. 그리고 배양액을 6,000 rpm에서 30분간 원심분리하여 상층액을 분리하였으며, 분리된 상층액은 여과지를 통해 정제하였다. 정제된 상층액에 ammonium sulfate를 80% 포화율까지 4℃에서 천천히 첨가하여 침전시켰다. 침전된 용액은 4℃에서 12시간 동안 보관하고 조효소를 포함한 pellet을 얻기 위해 원심분리하였다. 원심분리한 pellet을 tris buffer(pH 8.2)에 용해하고 4℃에서 24시간 동안 동일한 buffer에서 투석하였다. 이후, 조효소 추출액은 0.2 μm syringe filter로 여과하여 실험 사용 전까지 –70℃에서 보관하였다.
5. B. velezensis CE 100의 F. oxysporum 포자 발아 억제
고사한 묘목의 줄기에서 분리한 곰팡이병 병원균인 F. oxysporum을 7일간 배양한 PDA 배지에 멸균증류수를 첨가하고 멸균된 백금이로 표면을 긁은 후, 4겹의 거즈로 균사와 배지 조각을 여과하여 F. oxysporum의 포자 현탁액을 제작하였다. 포자현탁액의 농도는 멸균증류수와 혈구계산판을 사용하여 1×106 spores/mL로 조정하였다. B. velezensis CE 100의 조효소는 tris buffer를 사용하여 0 μL/mL(대조구), 250 μL/mL, 500 μL/mL 및 1,000 μL/mL로 조정하였다.
F. oxysporum의 포자 현탁액 100 μL와 증류수 550 μL, 4×PDB 250 μL 및 B. velezensis CE 100의 농도별 조효소 100 μL를 혼합하고 25℃에서 12시간 동안 배양하였다. 그리고 200배율의 광학현미경(NSB-80T, Samwon, Korea)을 이용해 대조구와 각각의 처리구에서 100개의 포자 중 발아한 포자의 수를 측정하였다. 발아관이 포자의 길이 이상으로 신장되었을 때 포자가 발아한 것으로 간주하였고, 실험은 3번 반복 수행되었다.
B. velezensis CE 100의 곰팡이병 병원균 포자 발아 억제율은 다음 공식을 이용하여 계산하였다.
(α는 대조구에서 발아한 곰팡이병 병원균의 포자의 수이며,
β는 처리구에서 발아한 곰팡이병 병원균의 포자의 수이다.)
6. B. velezensis CE 100의 F. oxysporum 균사 생장 저해
PDA 배지에 배양된 F. oxysporum을 cork border를 이용하여 직경 5 mm 플러그를 만든 후 새로운 PDA 배지에 접종하였다. 그리고 곰팡이병 병원균의 플러그에서 3 cm 떨어진 곳에 직경 5 mm의 구멍을 만들어 0 μL/mL(대조구), 25 μL/mL, 50 μL/mL 및 100 μL/mL로 농도를 조정한 B. velezensis CE 100의 조효소를 25 μL씩 접종하였다. 조효소 농도 조절에는 tris buffer를 사용하였다. 접종한 PDA 플레이트를 7일간 25℃에서 배양 후 저해율을 측정하였고, 실험은 3번 반복 수행되었다.
B. velezensis CE 100의 곰팡이병 병원균 균사 생장 저해율은 다음 공식을 이용하여 계산하였다.
(α는 대조구 plate의 곰팡이병 병원균의 반경방향 생장 길이이며,
β는 처리구 plate의 곰팡이병 병원균의 반경방향 생장 길이이다.)
B. velezensis CE 100이 곰팡이병 병원균의 균사 형태에 미치는 영향을 관찰하기 위해, B. velezensis CE 100이 균사 생장을 저해시킨 군집 경계에서 균사를 채취해 200배율의 광학현미경으로 관찰하였다.
7. 통계 분석
B. velezensis CE 100의 조효소에 의한 곰팡이병 병원균의 포자 발아 저해율 및 균사 성장 억제율은 일원배치 분산분석하였으며, 사후검정은 least significant difference(LSD) 분석을 실시하였다(p<0.05). 통계분석은 Statistical Package for the Social Sciences(SPSS) 통계 프로그램(SPSS 25.0, SPSS, USA)을 사용하였다.
결 과
1. 독일가문비 묘목에 발생하는 곰팡이병 병원균 분리 및 동정
고사한 묘목에서 분리한 1개의 곰팡이병 병원균을 NCBI의 BLAST search를 통해 reference 곰팡이 균주들의 염기서열 정보와 비교한 결과, F. oxysporum과 100%의 유사도를 나타내었고 Gibberella fujikuroi 및 F. verticillioides와는 99.94%의 유사도를 나타내었다(Table 2). 따라서 분리된 곰팡이병 병원균은 F. oxysporum으로 동정하였다.
Table 2.
BLAST search results of isolated fungus
| Accession number |
Description |
Percent identity (%) |
| MT102254.1 |
Fusarium oxysporum strain GF1 small subunit ribosomal RNA gene, partial sequence |
100.00 |
| XR_001936456.1 |
F. oxysporum f. sp. lycopersici 4287 18S ribosomal RNA (FOXG_22946), rRNA |
100.00 |
| MK889397.1 |
F. oxysporum f. sp. cubense race 4 isolate P.TJ1 (L18) small subunit ribosomal RNA gene, partial sequence |
100.00 |
| MK889390.1 |
F. oxysporum f. sp. cubense race 4 isolate P.TH14 (L11) small subunit ribosomal RNA gene, partial sequence |
100.00 |
| XR_008554444.1 |
F. oxysporum Fo47 18S ribosomal RNA (FOBC_06210), rRNA |
100.00 |
| KC143070.1 |
F. oxysporum strain 8-11P 18S ribosomal RNA gene, partial sequence |
100.00 |
| DQ916150.1 |
F. oxysporum 18S ribosomal RNA gene, partial sequence |
100.00 |
| AB110910.1 |
F. oxysporum gene for 18S rRNA |
100.00 |
| MT649536.1 |
F. oxysporum isolate 43 small subunit ribosomal RNA gene, partial sequence |
100.00 |
| HM165488.1 |
Gibberella fujikuroi strain SH-f13 18S ribosomal RNA gene, partial sequence |
99.94 |
| XR_001989347.1 |
Fusarium verticillioides 7600 18S ribosomal RNA (FVEG_17751), rRNA |
99.94 |
Download Excel Table
2. B. velezensis CE 100의 생장 패턴
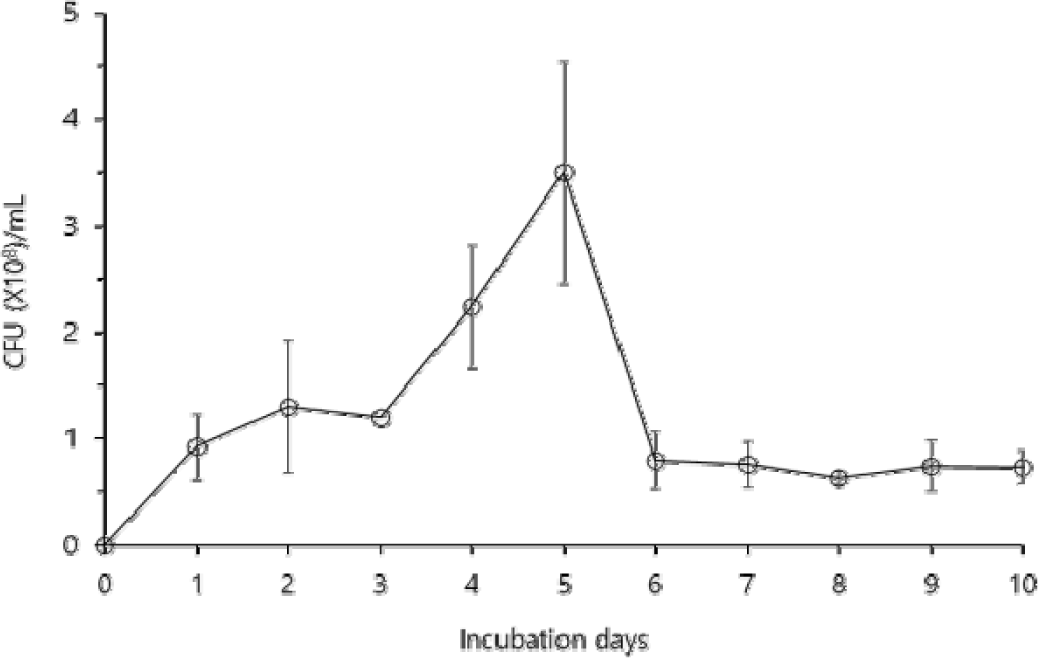
B. velezensis CE 100은 배양 2일차까지 생장이 증가하다가 3일차에 약간 감소하였고, 다시 증가하여 5일차에 3.50×108 CFU/mL로 최댓값을 나타내었다(Fig. 1). 그 후 B. velezensis CE 100의 생장은 급격하게 감소하여 배양 6일차에는 0.80×108 CFU/mL였으며, 이후 10일차까지 0.63∼0.80×108 CFU/mL의 일정한 생장을 유지하였다.
Fig. 1.
The cell growth pattern of Bacillus velezensis CE 100 during the 10 days of incubation. Error bars indicate the standard deviation from the mean (n=3).
Download Original Figure
3. B. velezensis CE 100의 용균효소 활성
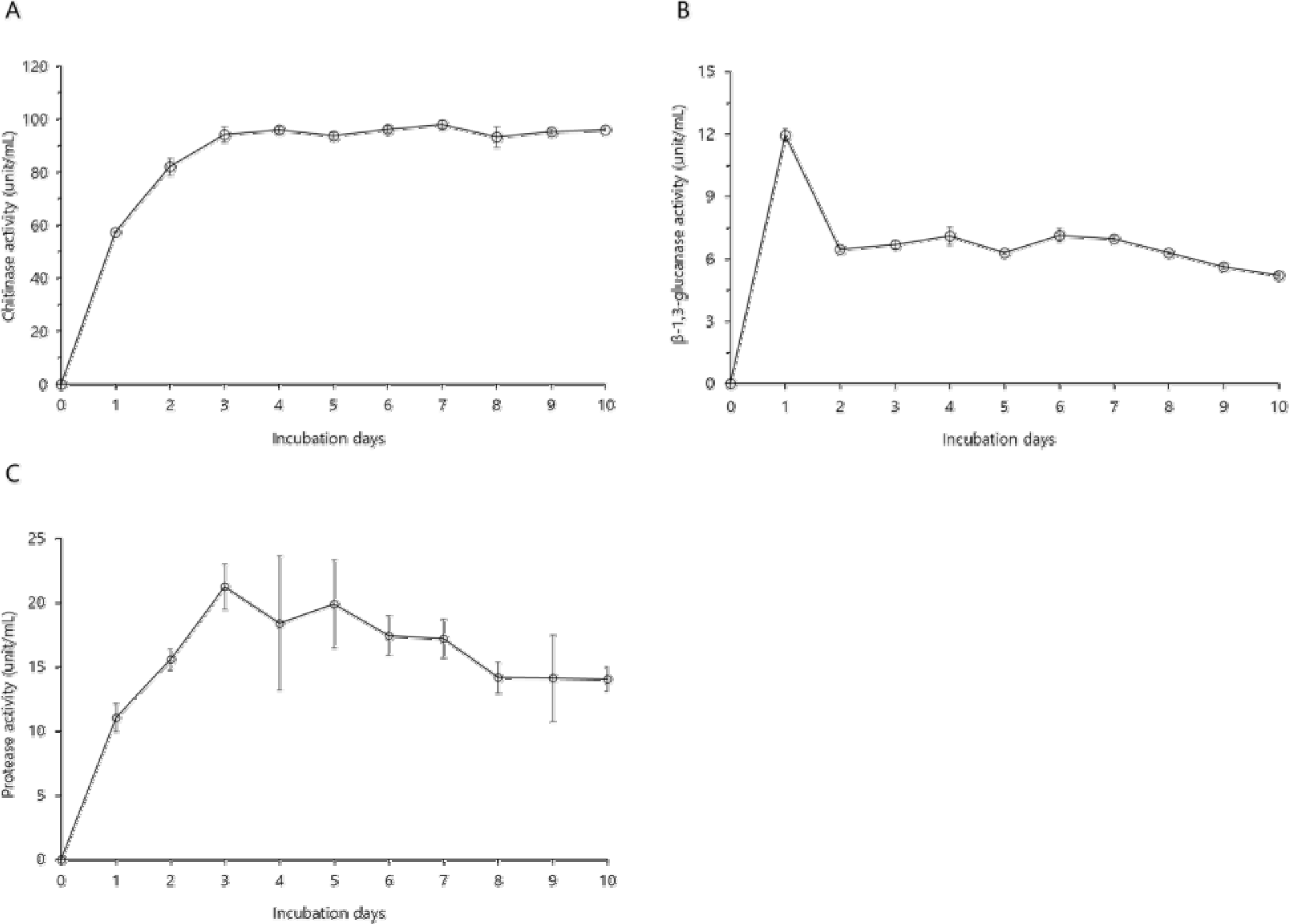
B. velezensis CE 100의 키틴분해효소 활성은 배양 초기부터 급격하게 증가하여 배양 3일차에 94.14 unit/mL를 나타내었다(Fig. 2A). 이후 배양 4일차부터 키틴분해효소 활성은 93.16∼97.79 unit/mL의 일정한 값을 유지하였고, 가장 높은 활성은 97.79 unit/mL로 배양 7일차였다.
Fig. 2.
The lytic activity of chitinase (A), β–1,3-glucanase (B), and protease (C) produced Bacillus velezensis CE 100 during the growth period. Error bars indicate the standard deviation from the mean (n=3).
Download Original Figure
B. velezensis CE 100의 β–1,3-글루칸분해효소 활성은 배양 1일차에 11.95 unit/mL까지 증가해 최대를 보였고, 2일차에 6.46 unit/mL로 감소하여 6일차까지 6.30~7.15 unit/mL의 활성을 나타내었다(Fig. 2B). 그 후 β–1,3-글루칸분해효소 활성은 점진적으로 감소하여 배양 10일차에 5.21 unit/mL로 최솟값을 나타내었다.
B. velezensis CE 100의 단백질분해효소 활성은 배양 3일차에 21.26 unit/mL까지 증가하여 최대를 보였고, 4일차에 18.41 unit/mL로 약간 감소하였다가, 5일차에 19.92 unit/mL의 활성을 나타내었다(Fig. 2C). 이후 단백질분해효소 활성은 점진적으로 감소하여 배양 10일차에는 14.06 unit/mL였다.
4. B. velezensis CE 100의 F. oxysporum 포자 발아 억제
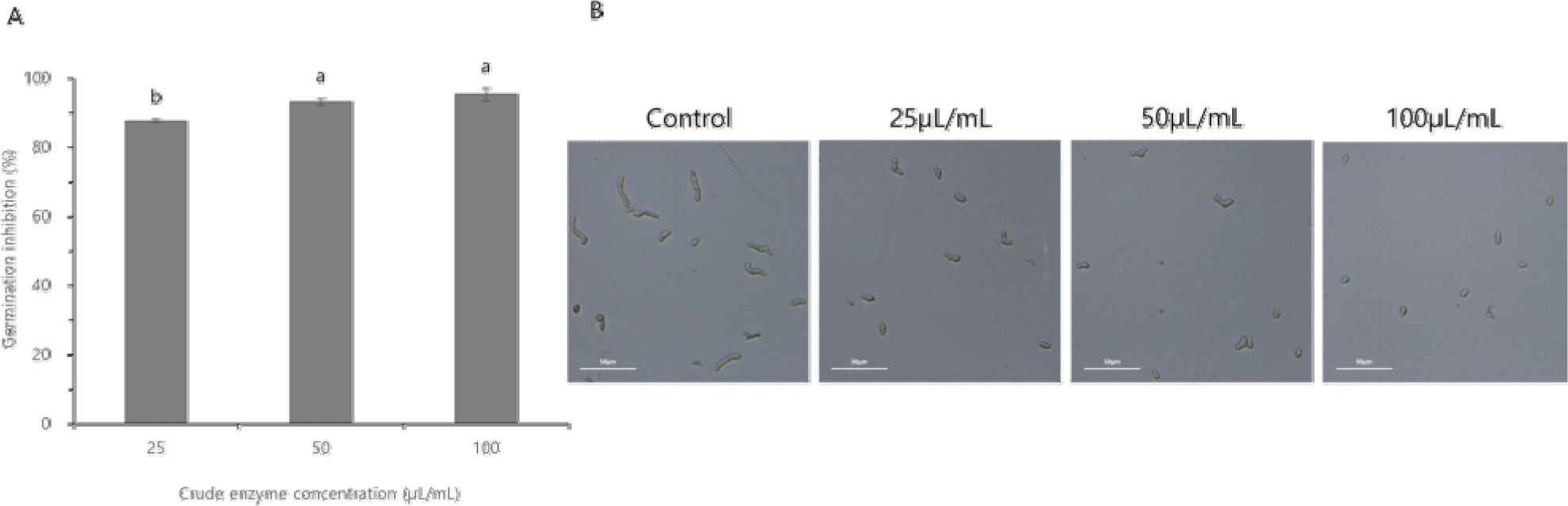
B. velezensis CE 100 조효소의 F. oxysporum 포자 발아 억제 효과를 분석한 결과, 조효소 25 μL/mL 농도에서 87.55%, 50 μL/mL 농도에서 93.04% 및 100 μL/mL 농도에서 95.24% 억제되었다(Fig. 3A). 그리고 대조구의 F. oxysporum 포자는 정상적으로 발아하였으나, B. velezensis CE 100의 조효소 처리구는 모든 농도(25 μL/mL, 50 μL/mL 및 100 μL/mL)에서 발아관 신장이 감소되었고 포자의 발아가 억제되었다(Fig. 3B).
Fig. 3.
The effect of the crude enzyme fraction from Bacillus velezensis CE 100 on the rate of spore germination inhibition of Fusarium oxysporum (A), and the micrographs showing spore germination of F. oxysporum (B). Error bars in the figure (A) represents the standard deviation from the mean (n=3), and the different superscripts in the figure indicate significant differences among treatment levels (p<0.05). The scale bars on the micrograph correspond to 50 μm.
Download Original Figure
5. B. velezensis CE 100의 F. oxysporum 균사 생장 저해
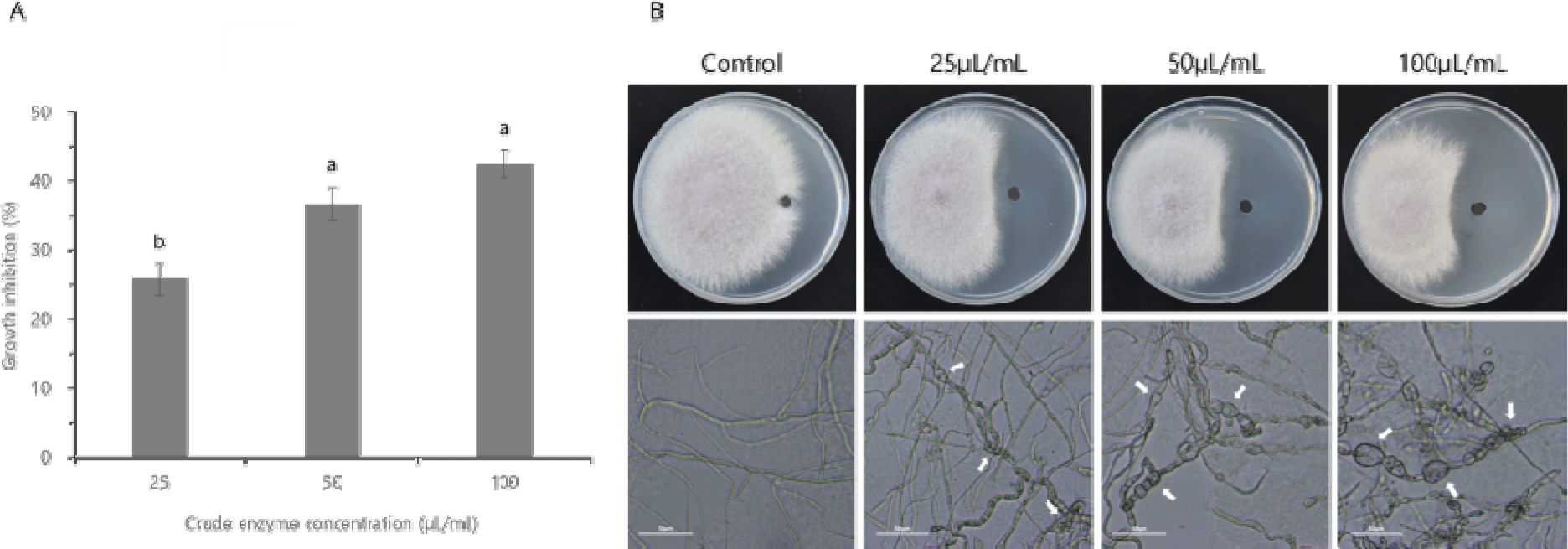
B. velezensis CE 100 조효소의 F. oxysporum 균사 생장 저해 효과를 분석한 결과, 균사 생장은 조효소 25 μL/mL 농도에서 25.83%, 50 μL/mL 농도에서 36.67% 및 100 μL/mL 농도에서 42.50% 저해되었다(Fig. 4A). 현미경으로 F. oxysporum의 균사 형태를 관찰하였을 때 대조구의 균사는 곧고 정상적인 형태였으나, 처리구의 균사는 뒤틀림 및 팽창 등의 비정상적인 형태를 보였다(Fig. 4B).
Fig. 4.
The effect of the crude enzyme fraction from Bacillus velezensis CE 100 on the rate of mycelial growth inhibition of Fusarium oxysporum (A), and the images of mycelial growth Inhibition of F. oxysporum on PDA plate and the corresponding micrographs showing the hyphal morphologies of F. oxysporum in each treatment group, observed under a light microscope (B). Error bars in the figure (A) indicate the standard deviation from mean (n=3), and the different superscripts indicate significant differences among the treatment levels (p<0.05). The white arrows on the micrographs indicate abnormal alternations of hyphae, and the scale bars correspond to 50 μm.
Download Original Figure
고 찰
모잘록병을 유발하는 F. oxysporum은 묘목을 고사시키는 곰팡이병 병원균으로, 전 세계적으로 독일가문비를 포함한 침엽수 양묘장에 흔히 발생하는 병해이다[6,9]. 본 연구에서도, 독일가문비 묘목이 모잘록병으로 고사하는 피해가 발생하였으며, 고사한 묘목에서 F. oxysporum이 분리 및 동정되었다(Table 2). F. oxysporum은 묘목의 물관을 막아 생육을 불량하게 하고 묘목을 고사시키기 때문에 건전한 독일가문비 묘목을 생산하기 위해서는 F. oxysporum을 억제하는 것이 필요하다[8–10]. F. oxysporum을 비롯한 대부분의 곰팡이병 병원균의 세포벽은 키틴과 β-1,3-글루칸이 교차결합하고 있는 내부 층과 단백질이 풍부한 외부 층으로 구성되어 있으며, 외부의 위협 요인으로부터 세포를 보호하고 세포의 활력과 형태를 유지하는 데 필수적인 역할을 한다[22]. 또한 곰팡이병 병원균의 세포벽은 포자 발아와 균사 생장을 가능하게 하여 숙주 세포로의 침투와 감염의 발판이 된다[22]. 포자는 곰팡이병 병원균을 확산시키는 수단이고, 확산된 포자는 발아하여 균사를 통해 숙주로 침투해 곰팡이병을 감염시킨다[22,24]. 식물성장촉진박테리아인 B. velezensis CE 100은 곰팡이병 병원균의 세포벽을 분해하는 키틴분해효소, β-1,3-글루칸분해효소 및 단백질분해효소의 활성을 보였다(Fig. 2). 따라서 B. velezensis CE 100의 조효소는 F. oxysporum의 포자와 균사에 대해 강력한 항균활성을 나타내었다(Figs. 3 and 4). 특히 B. velezensis CE 100의 조효소 25 μL/mL, 50 μL/mL 및 100 μL/mL를 처리한 시험구에서 포자 발아가 각각 87.55%, 93.04% 및 95.24% 억제되었다(Fig. 3A). 현미경으로 포자를 관찰했을 때 대조구의 포자는 정상적으로 발아한 반면, 조효소 처리구는 포자 발아가 대부분 이루어지지 않았다(Fig. 3B). 그리고 B. velezensis CE 100의 조효소 25 μL/mL, 50 μL/mL 및 100 μL/mL 농도에서 F. oxysporum의 균사 생장은 각각 25.83%, 36.67% 및 42.50% 저해되었다(Fig. 4A). F. oxysporum의 균사를 현미경으로 관찰했을 때 대조구의 균사는 곧고 온전하게 생장한 반면, 조효소를 처리한 실험구에서는 균사가 뒤틀리고 팽창된 비정상적인 형태가 관찰되었다(Fig. 4B). 식물성장촉진박테리아가 생산하는 키틴분해효소, β-1,3-글루칸분해효소 및 단백질분해효소와 같은 용균효소는 곰팡이병 병원균의 세포벽을 분해하여 세포의 인장강도를 낮추고 삼투압을 불안정하게 한다[24]. 분해된 세포벽과 불안정한 삼투압은 포자와 균사의 뒤틀림 및 팽창과 같은 비정상적인 형태를 야기시키고 곰팡이병 병원균의 포자 발아와 균사 생장 기능을 억제한다[15,16,25,26]. 즉, 곰팡이병 병원균의 세포벽을 분해하면 곰팡이의 생육을 억제할 뿐만 아니라 곰팡이의 식물 감염을 저해하여 곰팡이병의 방제가 가능하다[15,16]. Yun 등[17]은 용균효소를 생성하는 B. velezensis CE 100이 해송(Pinus thunbergii Parl.)에 발생하는 F. oxysporum의 포자 발아 및 균사 성장을 억제하여 해송의 생존율을 향상시켰음을 보고하였다. 본 연구에서도 B. velezensis CE 100이 용균효소를 생성하여 독일가문비에 발생하는 F. oxysporum의 포자 발아와 균사 생장을 억제하는 능력이 있음을 확인하였다. 이는 B. velezensis CE 100이 독일가문비 묘목에 발생하는 F. oxysporum을 효과적으로 방제하여 화학약제를 대체할 수 있는 곰팡이병 방제제로 사용될 수 있는 가능성을 보여준다.
요 약
본 연구는 독일가문비 묘목을 고사시키는 모잘록병의 병원균이 F. oxysporum임을 동정하였다. 그리고 B. velezensis CE 100이 키틴분해효소와 β–1,3-글루칸분해효소 및 단백질분해효소를 분비하여 F. oxysporum의 세포벽을 분해하고 포자 발아와 균사 생장을 억제함을 구명하였다. 따라서 본 연구의 결과는 B. velezensis CE 100이 모잘록병을 유발하는 F. oxysporum을 효과적으로 억제하여 독일가문비의 건전묘목 생산에 기여할 수 있음을 시사한다.
감사의 글
본 결과물은 2023년도 교육부의 재원으로 한국연구재단의 지원을 받아 수행된 지자체-대학 협력기반 지역혁신 사업의 결과입니다(2021RIS-002).
REFERENCES
Caudullo G, Tinner W, De Rigo D. Picea abies in Europe: distribution, habitat, usage and threats. In: De Rigo D, Caudullo G, Houston Durrant T, San-Miguel-Ayanz J, Mauri A, editors. European atlas of forest tree species. Luxembourg: Publications Office of the European Union; 2016. pp. 114-116.

Jansen S, Konrad H, Geburek T. The extent of historic translocation of Norway spruce forest reproductive material in Europe. Ann For Sci. 2017;74:56. .


Hannrup B, Cahalan C, Chantre G, Grabner M, Karlsson B, Bayon IL, et al. Genetic parameters of growth and wood quality traits in Picea abies. Scand J For Res. 2004;19:14-29. .


Jeran M, Pečan LI, Bar-rios-Francisco R. Interdisciplinary insight on European spruce (Picea abies): biologically active compounds and their usage. Proc Socrat Lect. 2021;6:64-70.

Menkis A, Vasiliauskas R, Taylor AFS, Stenström E, Stenlid, J, Finlay R. Fungi in decayed roots of conifer seedlings in forest nurseries, afforested clear‐cuts and abandoned farmland. Plant Pathol. 2006;55:117-129. .


Lilja A, Poteri M, Petaisto RL, Rikala R, Kurkela T, Kasanen R. Fungal diseases in forest nurseries in Finland. Silva Fenn. 2010;44:525-545. .


Bloomberg WJ. Diseases of Douglas-fir seedlings caused by Fusarium oxysporum. Phytopathology. 1971;61:467-470. .


James RL, Dumroese RK, Wenny, DL. Fusarium diseases of conifer seedlings. Victoria, BC: Forestry Canada, Pacific Forestry Centre; 1991. Report No.: BC-X-331.

Okungbowa FI, Shittu HO. Fusarium wilts: an overview. Environ Res J. 2012;6:83-102.

Guyon JC, complier. Investigations of Fusarium diseases within Inland Pacific Northwest forest nurseries. In: Proceedings of the 53rd Western International Forest Disease Work Conference; 2007 Aug 26-29; Jackson, WY.

Georgopoulos SG, Skylakakis G. Genetic variability in the fungi and the problem of fungicide resistance. Crop Prot. 1986;5:299-305. .


Agrawal A, Pandey RS, Sharma B. Water pollution with special reference to pesticide contamination in India. J Water Resour Prot. 2010;2:432-44. .


Wołejko E, Jabłońska-Trypuć A, Wydro U, Butarewicz A, Łozowicka B. Soil biological activity as an indicator of soil pollution with pesticides: a review. Appl Soil Ecol. 2020;147:103356. .


Yun JY, Kim HS, Moon JH, Won SJ, Choub V, Choi SI, et al. Antifungal and Plant-Growth Promotion Effects of Bacillus velezensis When Applied to Coastal to Pine (Pinus thunbergii Parl.) Seedlings. Forests. 2023;15:62. .


Skujins JJ, Potgieter HJ, Alexander M. Dissolution of fungal cell walls by a streptomycete chitinase and
β-(1→3) glucanase. Arch Biochem Biophys. 1965;111:358-364. .



Choi TG, Maung CEH, Lee DR, Henry AB, Lee YS, Kim KY. Role of bacterial antagonists of fungal pathogens, Bacillus thuringiensis KYC and Bacillus velezensis CE 100 in control of root-knot nematode, Meloidogyne incognita and subsequent growth promotion of tomato. Biocon Sci Technol. 2020;30:685-700. .


Feofilova EP. The fungal cell wall: modern concepts of its composition and biological function. Microbiology. 2010;79:711-720. .


Won SJ, Kim CW, Moon JH, Choi SI, Ajuna HB, Choub V, et al. Biological control of anthracnose fruit rot disease (Colletotrichum spp.) and fruit yield improvement of jujube (Zizyphus jujuba Miller var. inermis Rehder) using Bacillus velezensis CE 100. Biol Control. 2023;187:105405. .