REVIEW
파이토크롬 상호작용인자에 의한 식물의 고온 반응성 조절
Regulation of Plant Responses to High Temperatures by Phytochrome-Interacting Factors
Jeong-Hyeon Lee1
,
Seong-Hyeon Kim1
,
Jeong-Il Kim1,*
Author Information & Copyright ▼
1Department of Integrative Food, Bioscience and Biotechnology, Chonnam National University, Gwangju, Korea
*Corresponding author : Jeong-Il Kim, Department of Integrative Food, Bioscience and Biotechnology, Chonnam National University, Gwangju, Korea, Tel : +82-62-530-2189, E-mail :
kimji@chonnam.ac.kr
© Copyright 2023, Institute of Agricultural Science & Technology, Chonnam National University. This is an Open-Access article distributed under the terms of the
Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/4.0/) which permits
unrestricted non-commercial use, distribution, and reproduction in any
medium, provided the original work is properly cited.
Received: Dec 14, 2023 ; Revised: Dec 21, 2023 ; Accepted: Dec 26, 2023
Published Online: Dec 31, 2023
Abstract
Light and temperature are critical environmental signals for the regulation of plant growth and development. Thus, plants have to properly sense and respond to changing light and temperature conditions in surrounding environments. In particular, as global warming intensifies, adaptation to changes in ambient temperatures is considered as a crucial issue that has direct impacts on plant survival and reproduction. The suite of morphological and architectural changes induced by elevated ambient temperatures are collectively referred as thermomorphogenesis, in which representative phenotypes include elongated hypocotyls and petioles in seedlings, stem elongation, hyponastic leaf growth, decrease in leaf thickness, and early flowering. Plant red and far-red light-sensing phytochrome B (phyB) acts as a temperature sensor and phytochrome-interacting factor (PIF)-auxin signaling module is known to play critical roles for plant responses to high temperatures or thermomorphogenesis. Especially, PIF4 is well-known to be a key transcription factor for regulating responses to high temperatures in plants. In general, phyB acts as a negative regulator of PIF4 at optimum temperature but phyB is inactivated at higher temperatures, which increases the protein stability of PIF4. Consequently, the accumulated PIF4 induces thermomorphogenic responses by inducing the expression of genes involved in auxin biosynthesis and responsiveness. PIF4 is regulated not only by phyB but also by a key component of the circadian clock, evening complex (EC), constitutive photomorphogenic 1 (COP1), and elongated hypocotyl 5 (HY5). Recently, PIF7 has also been reported as another essential transcription factor in regulating high temperature responses in plants. In particular, as PIF7 is known to play important roles in shade avoidance responses of plants, it is involved in the regulation of thermomorphogenic responses under shade combined with high temperature conditions. In these conditions, PIF7 is dephosphorylated (i.e., active form) and induces the expression of auxin biosynthesis genes. In this review, we intend to summarize the function of phyB and PIFs for the regulation of plant responses to high temperatures.
Keywords: plant; phytochrome B; phytochrome-interacting factor; response to high temperature; thermomorphogenesis; phytochrome-interacting factor 4 (PIF4); PIF7
서 론
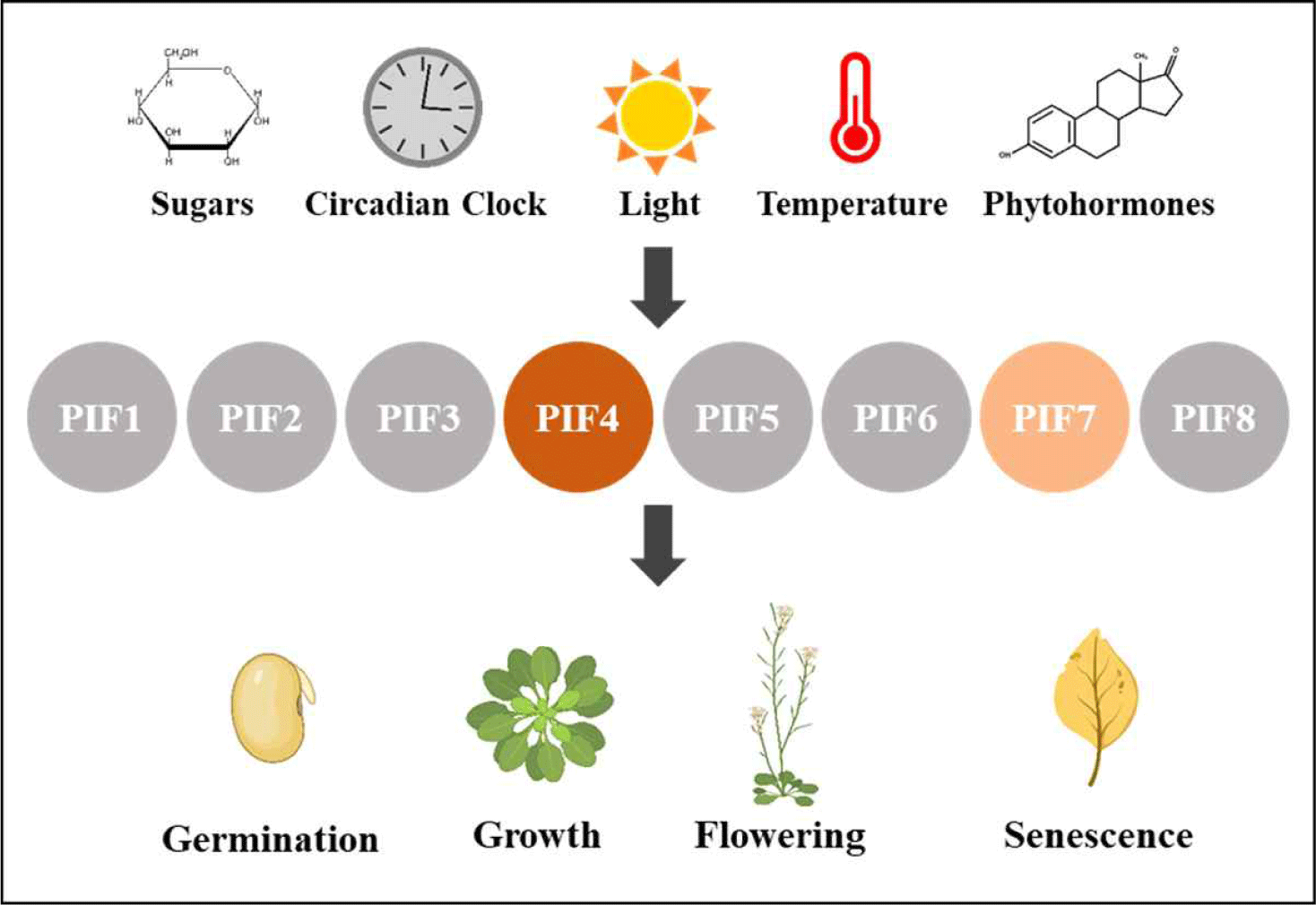
고착상태로 살아가는 식물은 주어진 환경에 적응하고 생존하기 위해 환경변화를 통합적으로 감지하여 생장과 발달을 조절해야 한다. 이때 빛과 온도는 식물 생장과 발달 조절에 가장 중요한 환경 신호이다. 빛의 인식은 외부 빛에 포함된 정보를 생물학적 신호로 변환하는 광수용체들에 의해 매개되며, 식물의 대표적인 광수용제로 청색광과 UV-A 빛을 감지하는 포토트로핀(phototropin)과 크립토크롬(cryptochrome), 적색 및 원적색광을 감지하고 반응하는 파이토크롬(phytochrome)이 있다[1]. 파이토크롬은 주로 빛의 적색(600–700 nm) 및 원적색광(700–750 nm)을 인지하여 두 가지 형태, 불활성 Pr 형태(red light-absorbing from) 및 활성 Pfr 형태(far-red light absorbing from)로 존재한다[2]. Pfr 활성 형태는 원적색광 흡수에 의한 광변환(photoconversion) 또는 고온 조건에서 열전환(thermal reversion)이라 불리는 온도 의존적 형태변환이 일어나 Pr 불활성 형태가 된다[3,4]. Pr 불활성 형태는 세포질에 존재하는 반면, Pfr 활성 형태는 핵으로 이동하여 하위 신호전달인자와의 상호작용을 통해 유전자 발현을 조절한다. 이때, 파이토크롬 상호작용인자(phytochrome-interacting factor, PIF)는 중요한 하위 신호전달인자로 암형태형성(skotomorphogenesis)을 유지하고 광형태형성(photomorphogenesis)를 억제하는 기능을 한다(Fig. 1). 애기장대(Arabidopsis thaliana) 모델식물에는 현재까지 8종의 PIF(PIF1–PIF8) 인자가 보고되었으며, 이들은 bHLH(basic helix-loop-helix) 도메인을 가진 전사인자이다[5]. 빛 조건에서 PIF 인자는 Pfr 형태의 파이토크롬과 직접적인 상호작용을 통해 인산화된 이후 유비퀴틴화 및 26S 프로테아좀 경로를 통해 분해된다[6,7]. PIF의 활성은 빛뿐만 아니라 온도, 생체시계, 당, 그리고 여러 식물 호르몬에 의해서도 제어되는 것으로 알려졌다[8].
Fig. 1.
Phytochrome-interacting factors (PIFs) in plant growth and development. PIFs are involved in the regulation of plant growth and development, such as germination, leaf and stem growth, flowering, senescence, and so on. There are 8 PIFs identified in Arabidopsis thaliana, and their functions are regulated by various external (light, temperature) and internal (sugars, circadian clock, phytohormones) signals. In particular, PIF4 and PIF7 play important roles for the regulation of plant responses to high temperatures.
Download Original Figure
온도는 식물의 생장과 발달뿐 아니라 지리적 분포 및 작물의 품질과 생산성에 영향을 미치며, 특히 지구 온난화가 심화됨에 따라 주변 온도 변화에 대한 적응은 식물의 생존과 번식에 직접적인 영향을 미치는 중요한 문제로 간주된다[9]. 식물이 보이는 고온 반응성은 일련의 형태학적 및 구조적 변화를 수반하는데, 이를 통칭하여 고온형태형성 또는 열형태형성(thermomorphogenesis)이라고 한다[10,11]. 애기장대의 경우, 고온에서 하배축(hypocotyl)과 잎자루(petiole)의 성장이 빨라 길이가 길어지고 잎자루의 신장은 또한 잎의 각도를 증가시키는 하편생장(hyponastic growth)을 유도한다. 반면, 떡잎(cotyledon)이나 잎(rosette leave)의 면적은 크게 변하지 않는데, 이는 고온형태형성이 단순히 식물 생장을 조절하는 것이 아니라 기관-특이적인 형태 변화를 유도하여 고온에서 살아남기에 적합한 형태를 만드는 것으로 여겨진다[11,12].
파이토크롬B(phyB)는 광수용체이면서 열 감지기(thermal sensor)로도 기능하며 이는 빛과 온도 신호 경로가 식물에서 밀접하게 연관되어 있다는 것을 제시한다[13,14]. 실제로 빛과 온도는 공통적으로 phyB의 광변환 및 열전환 특성을 변화시켜 단백질 구조 변화가 유도되고, 이는 음지(shade)나 고온에서 PIF 인자의 기능 조절로 이어진다. 고온에서 phyB는 Pfr 활성 형태에서 Pr 불활성 형태로 전환이 가속화되고, 이러한 phyB 기능 저하에 의해 PIF4 단백질이 축적되어 옥신(auxin) 생합성 유전자 등 표적 유전자 발현을 증가시킨다. 결과적으로 고온은 옥신 생합성을 증대시켜 하배축 신장 등을 촉진한다. 최근에는 PIF7 또한 고온에서 하배축 및 잎자루 신장 조절에 필수적인 역할을 하는 것으로 밝혀졌다[4,15,16].
본 논문에서는 고온 센서로서의 phyB 기능과 식물의 고온형태형성의 조절인자인 PIF4 및 PIF7에 의한 고온에서의 식물의 생장 및 발달 조절 과정을 제시하고자 한다.
본 론
1. 광수용체 phyB(phytochrome B)에 의한 식물의 고온 반응성 조절
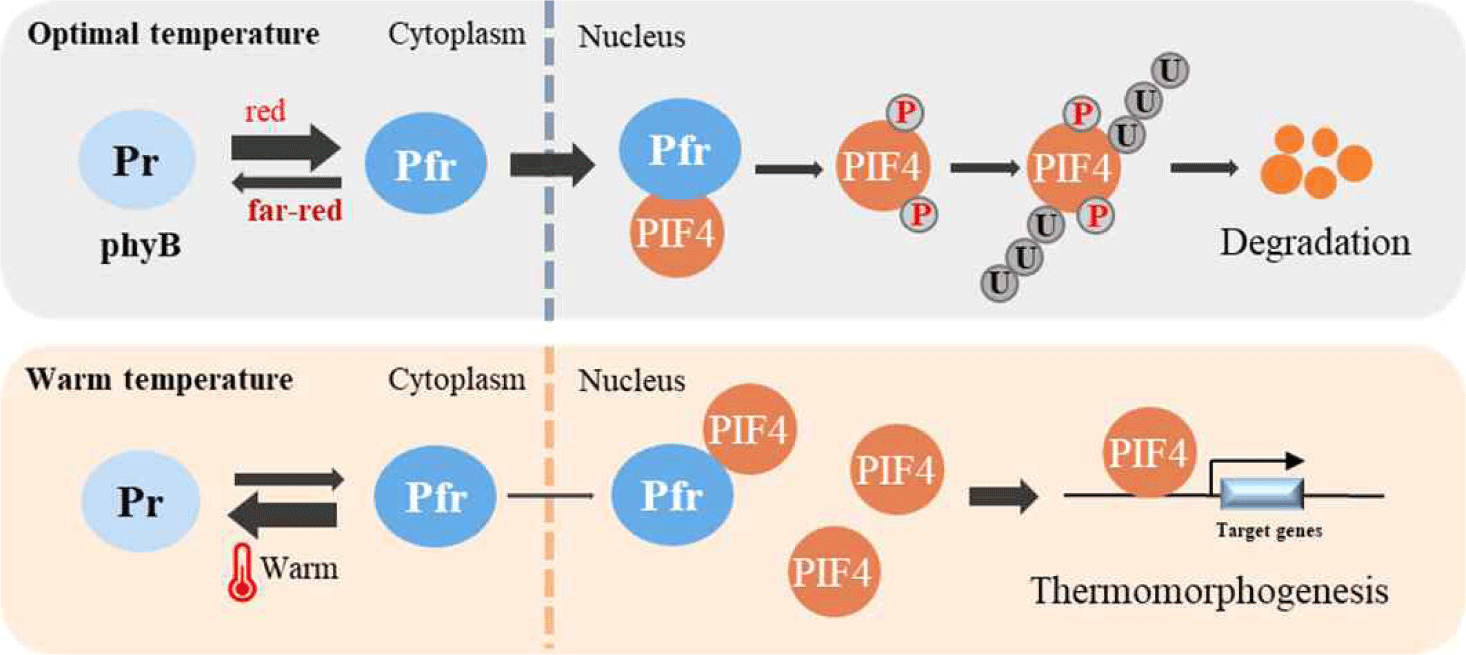
식물의 적색 및 원적색 광수용체인 phyB는 광 센서뿐만 아니라 온도 센서로 작용함이 보고되었다[13,14]. 이때 phyB의 광화학적 특성인 열전환(thermal reversion)이 주요한 역할을 하고 있음이 제시되었다. 즉, Pfr 활성 형태의 phyB는 열적으로 불안정하여 광변환과 상관없이 온도 의존적인 Pfr-to-Pr 변환에 의해 Pr 불활성 형태로 전환되는 열전환 과정을 이용하여 온도를 인지하여 작동할 수 있다. 이때 Pfr-to-Pr 전환 비율은 생리학적 범위(0–30도) 내에서 온도가 올라가면 비례적으로 증가한다[12]. 특히 Pfr-Pfr 동종이량체로서의 phyB 비율은 빛의 적색/원적색 비율에 따라 증가하고 온도에 따라 감소한다. 이러한 phyB 단백질의 구조적 변화는 하배축 성장을 포함하여 식물의 고온 반응성을 매개한다[4,17]. 따라서 온도가 올라가면 phyB는 Pr 불활성 형태 비율이 증가하게 되고, 이는 phyB에 의한 PIF4 활성 억제가 완화되는 결과를 초래하여 식물의 고온형태형성이 시작될 수 있다(Fig. 2).
Fig. 2.
Regulation of PIF4 by phytochrome B (phyB). Under daylight with optimal/normal temperature conditions, phyB undergoes photoconversion from the inactive Pr form to the active Pfr form. The photoactivated Pfr form translocates from the cytoplasm to the nucleus, where it interacts with PIF4 and induces its phosphorylation, leading to the subsequent degradation of PIF4 via ubiquitin/26S proteasome pathway. Under warm/elevated temperature conditions, phyB undergoes thermal reversion from the active Pfr form to the inactive Pr form, which significantly reduces the translocalization of phyB into the nucleus. Consequently, PIF4 degradation by phyB is reduced and the accumulated PIF4 induces expression of downstream target genes, which contribute to the thermomorphogenesis in plants. PIF, phytochrome-interacting factor.
Download Original Figure
애기장대에서 20℃ 적온에 비해 30℃ 고온에서 phyB의 핵 내 photobody(PB) 크기가 작아지고 양도 감소함이 확인되었으며, 이는 고온에서 열전환에 의해 phyB의 핵 내 축적이 감소함으로써 활성이 줄어드는 것을 제시한다[14]. 또한 phyB의 열전환은 두 단계로 일어난다는 것은 알려져 있는데, Pfr-Pfr 동종이량체에서 Pfr-Pr 이종이량체로의 열전환보다 Pfr-Pr 이종이량체에서 Pr-Pr 동종이량체로의 열전환이 광변환에 의한 Pfr-to-Pr 전환보다 거의 100배 빠르게 진행됨이 제시되었다[18]. 이에 식물의 주변 온도 상승은 phyB의 열전환(Pfr-to-Pr)을 가속화하고, 이를 통해 감소된 phyB 활성에 의해 PIF 인자의 불활성화가 억제되면서 식물의 고온형태형성 반응이 유도될 수 있다[19]. 이때 낮에는 광변환에 의한 Pr-to-Pfr 전환과 열전환(Pfr-to-Pr)에 따른 광 평형(photoequilibrium)에 의해 전체 파이토크롬 대비 Pfr 형성 비율(Pfr/Ptotal ratio)이 결정될 수 있으며, 적온 조건보다 고온 조건에서 Pfr/Ptotal ratio가 감소하여 PIF 인자 활성이 상대적으로 높게 유지될 수 있다. 밤에는 광변환 및 열전환 모두 Pfr 활성 형태에서 Pr 불활성 형태로의 전환이 이루어지기에, 고온 조건에서 Pfr-to-Pr 전환이 빠르게 일어나고 Pfr/Ptotal ratio가 더욱 낮게 형성되어 PIF 인자 활성이 더 높게 유지될 수 있다. 따라서 phyB는 적색광을 인지하여 Pfr 활성 형태가 만들어지면 PIF 인자를 불활성화 시켜 식물의 광형태형성 반응을 유도하는 반면, 고온 조건에서는 열전환에 의한 Pr 불활성 형태로의 전환이 빠르게 일어나 PIF 인자의 불활성화가 감소하면서 PIF 인자에 의한 옥신 생합성 유전자 발현을 통한 길이생장 유도를 포함한 식물의 고온형태형성 반응이 매개될 수 있다. 결론적으로 고착생물인 식물이 주변환경을 인지하는데 중요한 광 및 온도 신호를 phyB 광수용체를 이용하여 인지할 수 있도록 진화된 것으로 여겨진다.
2. 식물의 고온 반응성 조절의 중심인자 PIF4(phytochrome-interacting factor 4) 기능
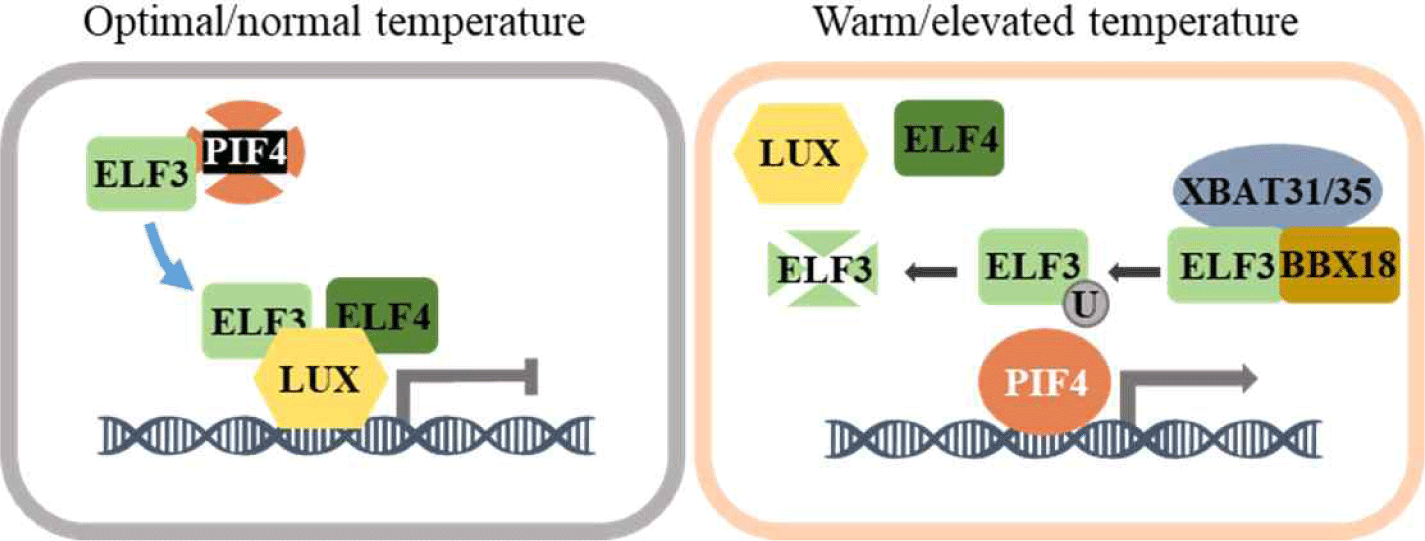
앞에서는 빛과 온도에 따른 식물의 반응성 조절을 광수용체인 phyB를 통해 제시하였지만, 파이토크롬 상호작용인자로 알려진 PIF4 역시 광신호전달뿐 아니라 식물의 고온형태형성 반응 조절의 핵심 전사인자로써 작동함이 보고되었다[4,15,20]. PIF4는 bHLH 전사인자로 다양한 하위 유전자의 발현을 조절한다고 알려져 있는데, 이를 통해 식물의 하배축 및 잎자루 신장을 포함한 다양한 생장과 발달에 관여한다[21]. 특히 PIF4 인자는 고온에서 발현이 높아지며 식물의 고온형태형성 반응을 유도하는 기능이 보고되었다(Fig. 3). 이러한 PIF4 인자에 의한 고온 반응성 조절에는 식물의 생체시계 조절인자인 ELF3(early flowering 3), ELF4(early flowering 4), LUX(lux arrhythmo) 등으로 구성된 EC(evening complex)에 의해 유도됨이 알려졌다[22]. EC는 초저녁에 식물의 생체시계를 조절하는 요소 중 하나로 알려져 있으며, 이들은 적온에서 PIF4 유전자의 전사를 억제한다. 또한 PIF4 단백질 안정성이 ELF3 존재 하에서 낮아지는 것이 알려져 있다. 그러나 고온 조건에서는 EC의 인자 중 하나인 ELF3이 BBX18(b-box 18) 및 XBAT35(xb3 orthlog 1 in A. thaliana)와 상호작용하여 유비퀴틴화를 통한 분해가 이루어져, 최종적으로 EC에 의해 억제되던 PIF4 유전자 발현이 증가되면서 축적된 PIF4에 의한 식물의 고온 반응성이 유도된다[23].
Fig. 3.
Regulation of PIF4 by a key component of the circadian clock, evening complex (EC). At optimal/normal temperature conditions, ELF3 reduces the protein stability of PIF4 and forms the EC with ELF4 and LUX. The EC suppresses the transcription of target genes of PIF4. Under warm/ elevated temperature conditions, ELF3 interacts with BBX18 and XBAT31/35 and undergoes degradation via ubiquitination. Subsequently, the protein stability of PIF4 increases, and the suppression of PIF4 by the EC is released, which in turn allows PIF4 to bind to the promoters of target genes, ultimately mediating plant responses to high temperatures (i.e., thermomorphogenesis). LUX, lux arrhythmo; XBAT35, xb3 orthlog 1 in Arabidopsis thaliana.
Download Original Figure
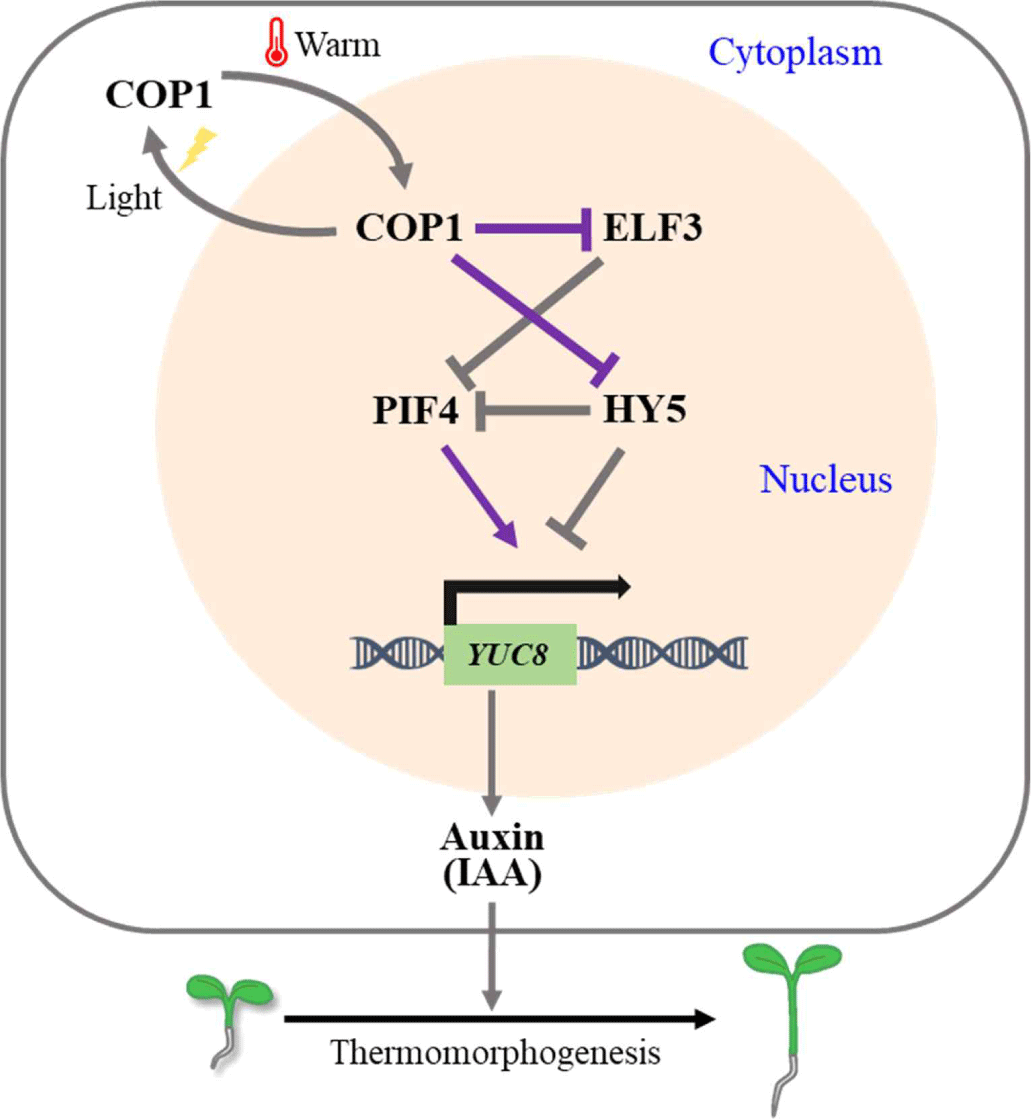
PIF4 인자의 기능 조절에는 광수용체 이외에 광신호전달인자들이 관여함이 보고되었는데, 여기에는 식물의 광 반응성 조절에 관여하는 COP1(constitutively photomorphogenic 1) 및 HY5 (elongated hypocotyl 5) 단백질이 중요한 역할을 한다. COP1은 E3 ligase 활성을 보유하고 있으며, 빛이 없는 암 조건에서 광형태형성 조절의 핵심 전사인자인 HY5 등을 분해하는 역할을 하고 있음이 잘 알려져 있다[24]. 반면에, 적온의 빛이 있는 조건에서는 광수용체에 의한 COP1의 불활성화와 세포질로의 이동으로 인해 HY5 전사인자가 분해되지 않고 핵 내에 축적되면서 광형태형성을 유도하는 유전자 발현을 조절하게 된다. 이때 HY5는 고온에 의해서도 발현이 유도되며 옥신 생합성에 관여하는 YUC8(YUCCA 8) 유전자 프로모터에 결합하는 PIF4 인자와 경쟁하여 PIF4에 의해 조절되는 하위 유전자 발현을 억제하는 기능이 보고되었다[25]. 또한 고온 조건에서 COP1의 핵으로의 이동성이 높아지고 HY5 분해를 촉진할 수 있음이 보고되었다[26]. 따라서 고온에서는 COP1이 핵으로 이동하여 HY5 인자를 분해시킬 수 있고, 이는 HY5에 의한 PIF4 억제작용을 감소시켜 PIF4 활성을 증대시킴으로서, 식물의 고온 반응성/열형태형성 반응을 유도하게 된다(Fig. 4). 참고로 COP1은 HY5뿐만 아니라 ELF3 분해에도 관여하며, 이를 통해 ELF3에 의한 PIF4 억제를 해제시킬 수 있다. 즉, 고온에 의해 핵으로 들어간 COP1은 PIF4 억제인자인 HY5 및 ELF3 등을 분해함으로써 PIF4 활성을 증대시키고, 이를 통해 옥신 생합성에 관여하는 YUC8 등의 유전자 발현 조절을 통해 옥신(IAA, indole-3-acetic acid) 호르몬에 의한 길이생장 등이 유도된 고온형태형성 반응이 나타나게 된다.
Fig. 4.
Regulation of PIF4 by COP1 under high temperature conditions. In the light, COP1 is translocalized from the cytoplasm to the nucleus. On the other hand, under warm/elevated temperature conditions, COP1 enters the nucleus and induces the degradation of ELF3 and HY5, i.e. two representative inhibitors of PIF4, which make PIF4 active. Consequently, PIF4 induced the expression of YUC8, a key enzyme for auxin (i.e, indole-3-acetic acid, IAA) biosynthesis, inducing thermormorphogenic responses including elongated growth of seedlings. PIF, phytochrome-interacting factor; COP1, constitutively photomorphogenic 1.
Download Original Figure
3. PIF7(phytochrome-interacting factor 7)에 의한 식물의 고온 반응성 조절
PIF7 전사인자는 본래 식물의 음지회피성(shade avoidance)에 관여하는 것으로 알려졌으며, 음지 조건에서는 탈인산화된 형태로 핵에 축적되어 옥신 생합성 및 반응성 유전자 발현을 조절함이 잘 알려져 있다[27]. 흥미롭게도 식물의 음지회피성 반응의 표현형과 고온 반응성 표현형은 유사하며, 여기에는 하배축이 신장되고 잎자루가 길어지는 등의 반응이 나타난다. 이러한 결과에 기초하여 비교적 최근에 음지와 고온을 동시에 처리하면 각각의 조건을 개별적으로 처리했을 때보다 하배축 신장이 더욱더 강하게 유도된다고 보고되었으며, 이때 음지와 고온에서 모두 작동하는 PIF7이 이러한 표현형을 결정하는데 중요한 전사인자로 제시되었다[28].
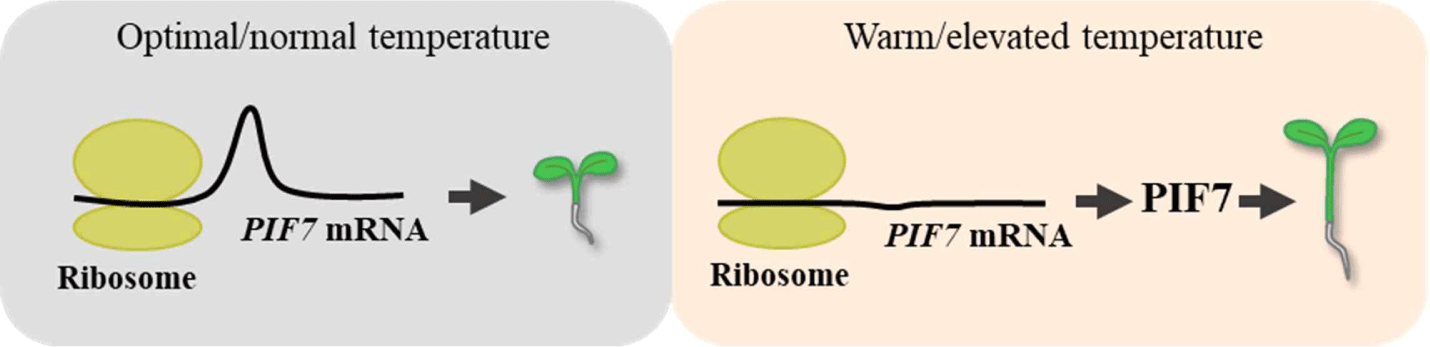
특히, 고온에서 PIF7 mRNA 수준은 변화하지 않고 단백질 수준만이 독립적으로 증가하는 양상을 보였다[15,29]. 이는 적온에서 PIF7 mRNA의 5'-비번역부위(5'-untranslated region)에 만들어지는 hairpin 구조에 의해 번역이 억제되는 반면, 고온에 의해 mRNA 2차 구조가 변형되어 hairpin 구조가 풀리고, 이를 통해 번역 촉진이 유도되기 때문이다(Fig. 5). 이후 번역된 PIF7 단백질 축적은 YUC8 발현에 직접적인 영향을 미침으로써 식물의 고온 반응성을 매개하게 된다.
Fig. 5.
Regulatory expression of PIF7 under high temperature conditions. At optimal/normal temperature conditions, a hairpin structure is formed in the 5'-untranslated region of PIF7 mRNA, which inhibits its translation. Thus, thermomorphogenic responses are not induced in plants. On the other hand, under warm/elevated temperature conditions, the structure of PIF7 mRNA is modified, in which the hairpin disappears, resulting in PIF7 translation. Consequently, PIF7 induces plant responses to high temperatures, including hypocotyl elongation.
Download Original Figure
요 약
빛과 온도는 식물의 생장과 발달을 조절하는 데 중요한 환경 신호이다. 이에 식물은 변화하는 빛과 온도 신호를 적절하게 감지하여 반응해야 한다. 특히 지구 온난화가 심화됨에 따라 주변 온도 변화에 대한 적응은 식물의 생존과 번식에 직접적인 영향을 미치는 중요한 문제로 간주된다. 상승된 주변 온도에 의해 유도되는 일련의 형태학적 및 구조적 변화를 고온형태형성이라고 하며, 대표적인 표현형으로 유묘에서의 길어진 배축과 잎자루, 줄기 신장, 잎의 토양에서 떨어지는 하편생장, 잎 두께의 감소, 조기 개화 등이 포함된다. 이때 식물의 적색광을 감지하는 파이토크롬B(phyB)가 온도 센서로 작용하며, 파이토크롬 상호작용인자(PIF)-옥신(auxin) 신호 모듈이 식물의 고온형태형성에 중요한 역할을 하는 것이 알려져 있다. 특히, PIF4는 식물의 고온 반응성을 조절하는 핵심 전사인자로 잘 알려져 있다. 일반적으로 phyB는 최적 온도에서 PIF4 인자의 음성 조절자 역할을 하지만, 높아진 온도에서는 phyB가 비활성화되어 PIF4의 단백질 안정성이 증가한다. 결과적으로 축적된 PIF4는 옥신 생합성 및 반응성에 관여하는 유전자 등의 발현을 유도하여 식물의 고온 반응성을 유도하게 된다. PIF4 인자는 phyB뿐만 아니라 생체시계의 주요 구성 요소인 저녁 복합체(EC), COP1(constitutively photomorphogenic 1) 및 elongated hypocotyl 5(HY5)에 의해서도 조절된다. 최근에는 PIF7 인자도 고온 반응성 조절에 또다른 필수 전사인자로 보고되었다. 특히, PIF7 인자는 식물의 음지 회피 반응에 중요한 역할을 하는 것으로 알려져 있어, 음지와 고온이 함께 처리된 조건에서 고온형태형성 반응의 조절에 관여한다. 이러한 조건에서 PIF7 인자는 탈인산화 되어 활성화 형태가 되며, 이는 옥신 생합성 유전자 등의 발현을 유도한다. 본 논문에서는 식물의 고온 반응성 조절에서 phyB 및 PIF 인자들의 기능을 요약하고자 한다.
감사의 글
본 논문은 융합식품바이오공학개론 강의를 통해 작성되었습니다. 그리고 본 연구는 한국연구재단 중견연구자지원사업(과제번호: 2021R1A2C1012562)의 지원에 의해 이루어진 것입니다.
References
Lee JH, Kim JY, Kim JI, Park YJ, Park CM. Plant thermomorphogenic adaptation to global warming. J. Plant Biol. 2020;63:1-9. .