서 론
환경문제와 석유 자원의 고갈로 재생 가능한 친환경 자원에 관한 관심이 증가하고 있다. 친환경 자원으로 목질계 바이오매스가 대표적이며, 이것은 비식용 자원 중 하나로 식량자원과 경쟁하지 않기 때문에 자원 공급에 유리하다[1]. 목질계 바이오매스는 종이, 건축자재, 가구 등 다양한 분야에서 활용되고 있다. 목질계 바이오매스를 건축자재나 가구 등으로 이용하기 위해서는 원목으로부터 사용하기 적합한 크기로 제재해야 한다. 이 과정에서 톱밥과 같은 부산물이 발생하고 있으며, 발생량은 연간 총 목재 사용량의 40% 정도이다[2]. 제재부산물을 재활용하는 경우는 43.4%이며, 나머지는 소각되거나 매립되고 있다[2]. 따라서 제재부산물 재활용을 위한 연구가 필요한 실정이다.
최근 생분해성 플라스틱은 다양한 소재로부터 개발되고 있다[3]. 생분해성 플라스틱 생산을 위해 수지와 셀룰로오스 또는 리그닌을 혼합한 연구가 진행되고 있으며, 이것은 생분해성 플라스틱 생산을 위한 원료로 목질계 바이오매스가 대체 가능하다는 것을 의미한다[4]. 기존의 연구는 목질계 바이오매스의 구성성분을 분리하여 혼합하거나 나노셀룰로오스를 제조하여 첨가하였으며 이러한 과정에 많은 에너지가 소모된다. 목질계 바이오매스의 구성성분을 분리하지 않고 직접 첨가하게 된다면 기존의 방법과 비교하여 에너지와 비용 측면에서 유리하다. 따라서 제재부산물을 생분해성 플라스틱 생산에 사용한다면 친환경과 관련된 사회적 이슈를 해결하고 제재부산물의 재활용과 연계한 산업화가 가능할 것이다. 하지만 생분해성 플라스틱 생산에 사용되는 친환경 수지와 목질계 바이오매스 사이의 친/소수성 차이가 있어 복합재료 계면의 적합성에 문제가 발생한다[4]. 따라서 제재부산물을 그대로 사용한다면 친환경 수지와 제재부산물 사이의 상의 차이로 적절하게 혼합되지 못하는 문제점이 있다. 따라서 친환경 수지와 혼합하기 위해서는 제재부산물의 소수화가 필요하다.
목질계 바이오매스는 다량의 수산기를 포함하고 있으며, 이것은 친환경 수지와 혼합에 저해 인자로 작용한다. 따라서 수산기를 제거하기 위한 적절한 방법이 필요하다. 반탄화는 목질계 바이오매스로부터 수산기를 제거할 수 있는 간단한 방법이다. 반탄화는 목질계 바이오매스를 무산소 조건, 낮은 반응온도(200℃–300℃)에서 1시간 이내 처리하는 건식열분해 반응이다[5]. 이 과정에서 목질계 바이오매스에 포함된 수분, 휘발성 물질이 주로 제거되며 헤미셀룰로오스 일부가 분해된다. 따라서 반탄화 바이오매스는 소수성이 되어 친환경 수지와 혼합에 적합한 소재가 된다. 또한, 목질계 바이오매스의 구성성분이 일부 분해되어 분쇄과정에서 에너지를 절감할 수 있다[6]. 이와 유사한 반응인 습식 반탄화는 수분을 포함한 반탄화 과정으로 헤미셀룰로오스 분해를 유도하며 다양한 휘발성 물질을 제거한다[7]. 건식 반탄화와 비교하여 같은 반응 조건에서 바이오매스의 높은 분해율을 나타내는 것이 특징이다[8]. 본 연구에서는 생분해성 플라스틱 생산에 제재부산물을 활용하기 위해 건식과 습식 반탄화 방법을 적용하였으며, 반탄화 시료의 화학적·구조적 특성을 비교 분석하고자 한다.
재료 및 방법
본 연구에서는 레드파인(Pinus resinosa) 제재부산물을 ㈜대현우드로부터 받아 공시재료로 사용하였다. 제재부산물을 20–80 mesh 크기로 분쇄하여 건식과 습식 반탄화에 사용하였다. 분쇄된 시료의 함수율은 10% 미만으로 유지하였다.
제재부산물의 구성성분은 NREL(National Renewable Energy laboratory) 방법으로 분석하였다[9]. 바이오매스의 회분 함량은 TAPPI Standard Method(T211-om-02)를 변형하여 775±25℃에서 6시간 연소시켜 측정하였다.
바이오매스와 증류수를 1:8(w/w) 비율로 혼합한 후 회전식 반응기(EMV-HT/HP600-3, E.M.S. Korea, Korea)에서 습식 반탄화를 수행하였다. 승온속도 4℃/min으로 200℃까지 도달한 후 반응 시간 10분, 30분, 60분을 각각 유지하였다. 반응이 종료된 후 100℃ 이하로 냉각시켜 액상 가수분해산물과 고형바이오매스를 여과하여 분리하였으며, 고형바이오매스의 구성성분은 2항의 방법으로 분석하였다. 액상 가수분해산물에 포함된 당류와 당분해산물은 HPLC(Waters 2695, USA)를 이용하여 분석하였다. 분석칼럼으로 Aminex 87H column(300×7.8 mm, BIO-RAD)과 검출기로 Refractive index detector(Waters 2414)를 사용하였다. 이동상은 5 mM H2SO4를 사용하였으며, 0.6 mL/min 속도로 이동상을 흘려보내 55분 동안 분석하였다. 리그닌 분해산물인 total phenolic compounds (TPC) 함량은 Folin-Ciocalteu’s reagent를 이용하여 측정하였다[10].
바이오매스는 105±3℃의 건조기에서 24시간 건조하였으며, 건조된 바이오매스 30 g을 탄화로(HTF-Q100, Hantech, Korea) 쿼츠관에 투입하여 질소 분위기(300 mL/min)에서 반탄화를 수행하였다. 승온속도는 3℃/min으로, 200℃까지 도달한 후 10분, 30분, 60분을 각각 유지하였다. 반응 후 반탄화 시료를 회수하였으며 2항의 방법으로 반탄화 바이오매스의 구성성분을 분석하였다.
바이오매스 결정화도는 3D 고분해능 X선 회절분석기(Empyream, Malvern Panalytical, Netherlands)를 이용하여 2θ=5℃–50℃, 40 kV, 30 mA의 조건에서 분석하였다. 결정화도는 식 (1)에 의해 결정성 영역을 계산하였다[11].
바이오매스의 구조 및 결합 양식 등을 파악하기 위해 푸리에 변환 적외선 분광기(fourier transform infrared spectroscopy, FTIR) (Spectrum 400, PerlomElmer, USA)를 이용하였다. 스펙트럼 파장 4,000–500 cm–1의 범위에서 4 cm–1의 해상도로 32회 스캔하여 측정하였다.
바이오매스의 열중량 분석은 열중량 분석기(Discovery TGA, TA Intruments, USA)를 이용해 10℃/min의 속도로 800℃까지 아르곤 가스 분위기에서 수행하였다.
바이오매스의 수분 흡수능력을 평가하기 위해 바이오매스는 무게를 측정한 후 105℃ 건조기에서 24시간 동안 건조했다. 데시게이터에 35% NaCl 용액 1L를 넣은 후 습도가 70%–80% 되도록 유지하였으며, 건조된 바이오매스를 넣고 6시간 동안 1시간마다 무게를 측정하여 수분 흡수량을 측정하였다.
결과 및 고찰
습식 반탄화 후 제재부산물의 분해율은 18.25%–23.13%로 나타났으며, 건식 반탄화와 비교했을 때 높은 분해율을 나타냈다. 습식 반탄화는 물을 사용한 반응으로 높은 온도에서 생성되는 하이드로늄이온(H3O+)은 약산 역할을 하여 산 촉매 반응과 유사한 효과를 유도한다[12]. 따라서 습식 반탄화 과정에서 바이오매스 주요 구성성분 중 낮은 온도에서 분해가 시작되는 헤미셀룰로오스가 주로 분해되어 분해율이 상대적으로 높았으며[12], 반응시간이 길어질수록 분해율은 증가하였다. 반면 건식 반탄화 분해율은 3.12%–3.83%로 상대적으로 낮았다. 반응시간에 따라 큰 차이를 나타내지 않았다. 주로 수분, 휘발성 추출물이 제거되고 일부 헤미셀룰로오스의 분해가 일어난 것으로 판단된다[12].
제재부산물 구성성분은 글루칸 38.49%, 리그닌 34.45%로 일반적인 침엽수 구성성분 함량을 나타냈으며, 헤미셀룰로오스 대표 성분은 galactoglucomannan으로 만난을 8.36% 포함하고 있었다. 건식 반탄화 바이오매스의 경우 헤미셀룰로오스 구성성분이 일부 분해되었으며 상대적으로 글루칸과 리그닌 함량이 증가하였다. 반응시간 증가에 따라 구성성분 함량에서 큰 차이는 나타나지 않았다. 이것은 중량감소율 결과와 일치하였다. 반면, 습식 반탄화 바이오매스의 헤미셀룰로오스 성분은 대부분 분해되었으며 상대적으로 글루칸과 리그닌 함량이 증가하였다. 이것은 중량감소율과 비교하였을 때 대부분의 헤미셀룰로오스가 분해되었음을 의미한다. 셀룰로오스 함량은 생분해성 플라스틱 생산에서 강도를 부여하는 주요 성분으로 특히 습식 반탄화 바이오매스에서 높은 함량을 나타냈다.
습식 반탄화 액상 가수분해산물의 화학성분 분석 결과는 Table 1과 같다. 주요 분해산물은 헤미셀룰로오스에서 유래한 만노오스이며, 습식 반탄화 시간이 증가할수록 농도는 증가하였다. 이것은 바이오매스 구성성분 결과와 일치하였다(Table 2). 6탄당 유래 분해산물인 포름산과 HMF(hydroxymethylfurfural), 5탄당 유래 푸르푸랄의 농도는 습식 반탄화 시간이 증가할수록 증가하였다. 침엽수 헤미셀룰로오스는 활엽수 헤미셀룰로오스 구조와 비교하여 낮은 빈도의 아세틸기를 포함하고 있어 아세트산의 농도는 상대적으로 낮았다[13]. 리그닌 분해산물인 TPC 함량은 습식 반탄화 시간에 따라 증가하였으며 이것은 리그닌의 일부가 분해되었음을 의미한다. 액상 가수분해산물의 pH는 습식 반탄화 시간이 증가할수록 낮은 값을 나타냈으며, 이것은 헤미셀룰로오스와 셀룰로오스 분해에 의해 생성된 아세트산과 같은 유기산에 의한 것으로 판단된다[10].
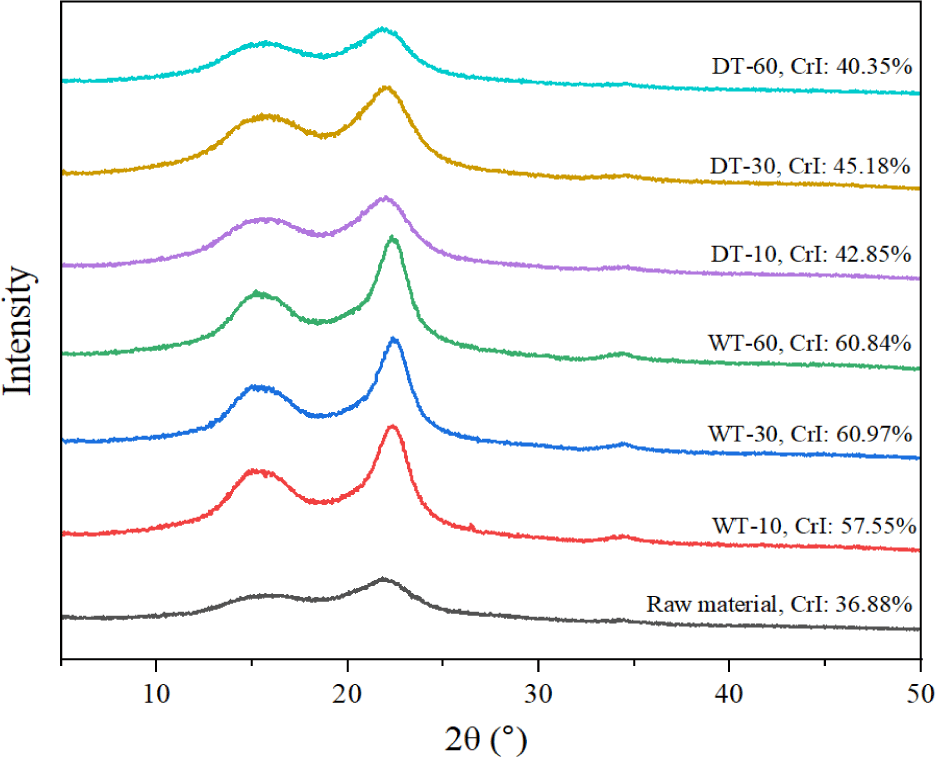
제재부산물의 원시료와 반탄화 바이오매스의 결정화도 결과는 Fig. 1에 나타냈으며, 원시료의 결정화도는 36.88%로 다른 침엽수의 결정화도와 유사하였다[14]. 습식 반탄화 바이오매스의 결정화도는 상대적으로 증가(57.55%–60.97%)하였으며, 반응시간이 30분과 60분 사이에서는 큰 차이를 나타내지 않았다. 이것은 바이오매스 구성성분 분석 결과(Table 2)와 일치하였다. 습식 반탄화에 의해 헤미셀룰로오스와 셀룰로오스의 비결정성 영역이 분해되어 상대적으로 결정화도가 증가하였다. 반면 건식 반탄화 바이오매스의 결정화도는 원시료와 비교하여 크게 증가하지 않았다(40.35%–45.18%). 이것은 건식 반탄화에 의한 중량감소율, 구성성분 결과와 일치하였다(Table 2). 바이오매스 결정화도는 생분해성 플라스틱 생산에서 셀룰로오스의 강도과 관련되며 그 값이 증가할수록 생분해성 플라스틱 강도에 긍정적인 영향을 줄 것으로 예측된다.
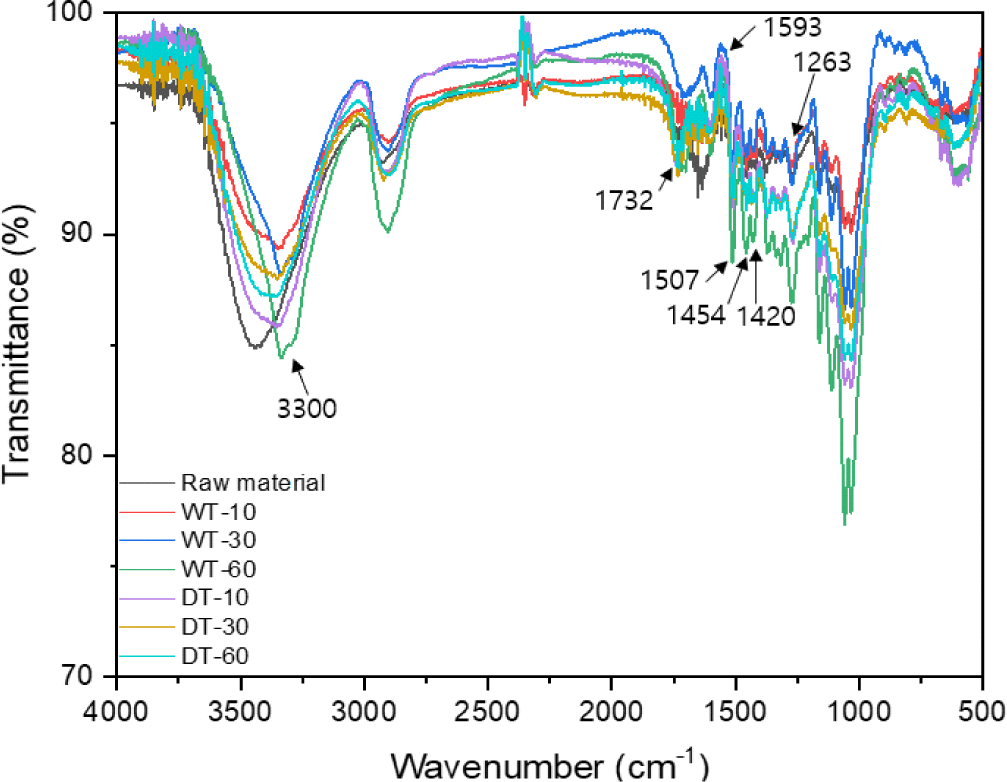
반탄화 바이오매스의 구조변화를 확인하기 위하여 FTIR 분석을 하였으며, 그 결과는 Fig. 2와 같다. 원시료와 건식 및 습식 반탄화 바이오매스에서 공통적인 흡수밴드가 확인되었다. 원시료와 비교하여 습식 반탄화 바이오매스에서 셀룰로오스의 수소결합 및 결정성 셀룰로오스를 나타내는 3,300 cm–1 영역에서 흡수 피크의 변화를 확인하였다[15]. 이것은 헤미셀룰로오스 분해에 의한 상대적인 결정성 영역의 증가에 의한 것으로 판단된다. 반면 건식 반탄화 바이오매스에서 그 변화는 미미하였다. 헤미셀룰로오스와 관련된 흡수 피크 1,420 cm–1와 1,732 cm–1에서 습식 반탄화 바이오매스의 변화를 확인하였으며, 이것은 헤미셀룰로오스 분해에 의한 것으로 건식 반탄화 바이오매스에서 변화는 미미하였다[16]. 리그닌과 관련된 흡수 피크(1,263, 1,454, 1,507, 1,593 cm–1)의 변화도 나타났으며, 원시료와 비교하여 건식 반탄화 바이오매스에서보다 습식 반탄화 바이오매스에서 차이를 나타냈다[16].
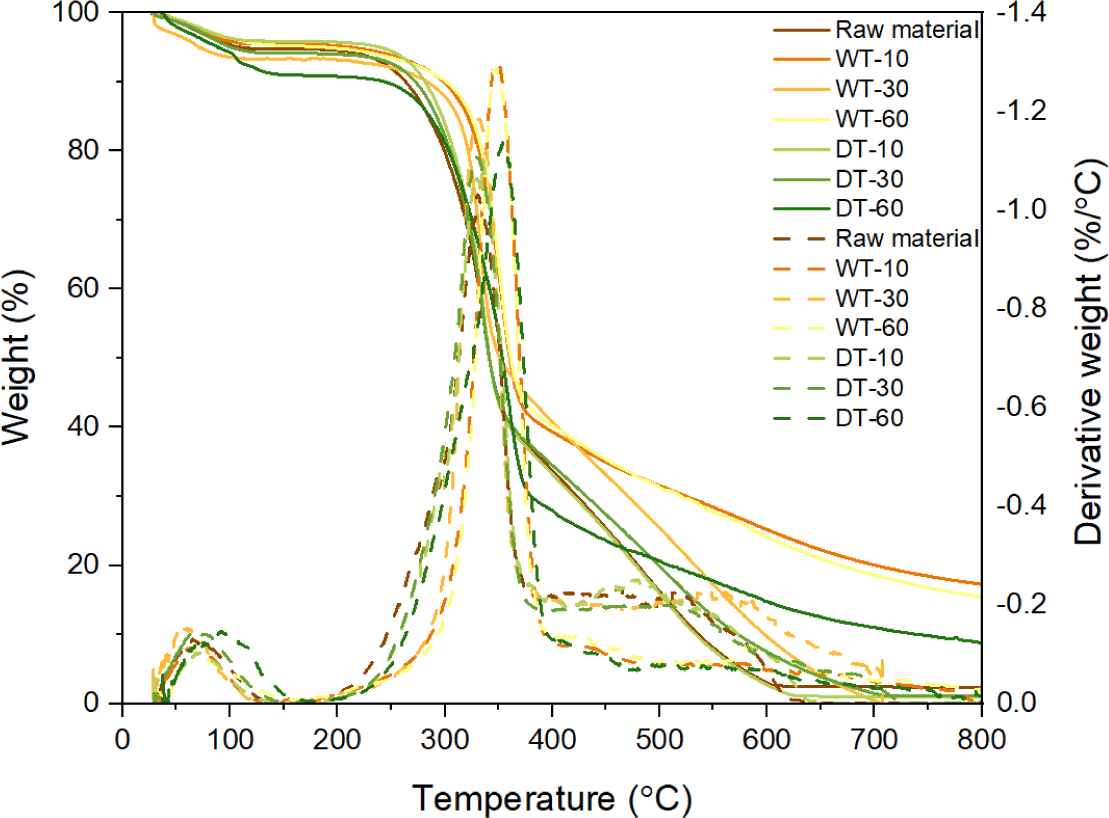
원시료와 반탄화 바이오매스의 열중량 분석 결과는 Fig. 3과 Table 3에 나타냈으며, 바이오매스 열분해는 약 100℃–800℃ 사이에서 광범위하게 나타났다. 모든 바이오매스 약 100℃에서 소폭의 중량감소가 일어났으며 이것은 수분 및 일부 휘발성 물질의 제거에 의한 것이다. 반면 250℃–350℃ 구간에서 급격한 중량감소가 일어났으며 이것은 목재의 구성성분 중 헤미셀룰로오스의 분해에 의한 것으로 판단된다. 일반적으로 헤미셀룰로오스의 분해는 주로 200℃–300℃에서 일어나며, 셀룰로오스는 좁은 범위(300℃–360℃)에서 흡열반응으로 빠르게 분해된다. 반면 리그닌은 거대한 분자량을 가진 방향족 고분자로 넓은 온도(160℃–900℃) 범위에 걸쳐 발열반응에 의해 분해된다[12]. 반탄화 바이오매스의 열분해 시작온도(Ti)는 원시료(189.99℃)와 비교했을 때 높아졌으며(191.07℃–221.07℃), 반탄화 온도가 증가할수록 증가하였다. 최대 중량감소가 일어나는 온도(DTGmax)는 원시료(329.55℃)와 비교하여 반탄화 바이오매스(332.30℃–351.78℃)에서 높았다. 반탄화 방법을 비교하였을 때 습식 반탄화에서 높은 최대 중량감소 온도를 나타냈다. 이것은 반탄화 과정에서 중량감소 및 헤미셀룰로오스 분해의 차이로 습식 반탄화 바이오매스에서 비교적 열에 안정한 리그닌 함량의 증가로 열분해 온도가 높게 나타난 것으로 판단된다[15–17]. 원시료와 비교하여 열에 대한 안정성이 확보된 반탄화 바이오매스는 생분해성 플라스틱 생산에 있어 우수한 첨가제로 활용될 수 있을 것이다.
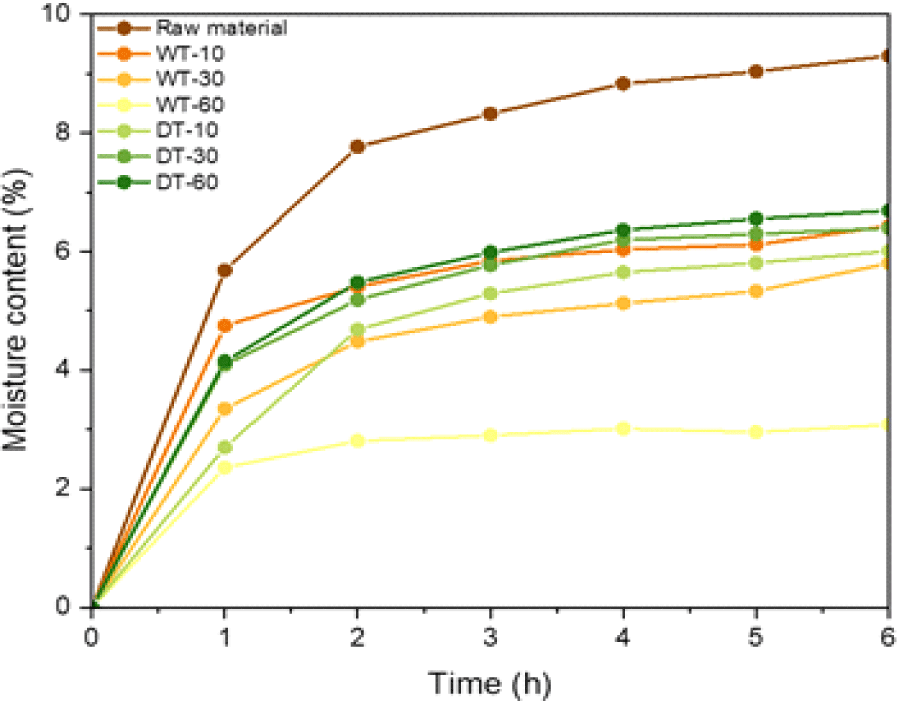
원시료와 반탄화 바이오매스의 시간에 따른 수분 흡수능력은 Fig. 4에 나타냈으며, 반탄화 과정에서 수분 및 헤미셀룰로오스가 제거되어 수산기가 감소하였다[18]. 반탄화 바이오매스의 수분 흡수능력은 원시료와 비교하여 낮은 값을 나타내고 있으며 습식 반탄화 60분 조건에서 가장 낮은 수분 흡수능력을 나타냈다. 습식 반탄화 바이오매스와 비교하여, 상대적으로 낮은 중량감소율을 나타낸 건식 반탄화 바이오매스에서 높은 수분 흡수능력을 나타냈다. 이것은 반탄화 과정에서 중량감소 및 헤미셀룰로스 분해의 차이에 의한 것으로 판단된다. 바이오매스는 반탄화 과정에서 소수성 특성을 갖게 되어 생분해성 플라스틱 생산에 첨가제로 사용되었을 때, 친환경 수지와 혼합하기 적합한 소재로 활용될 수 있다.
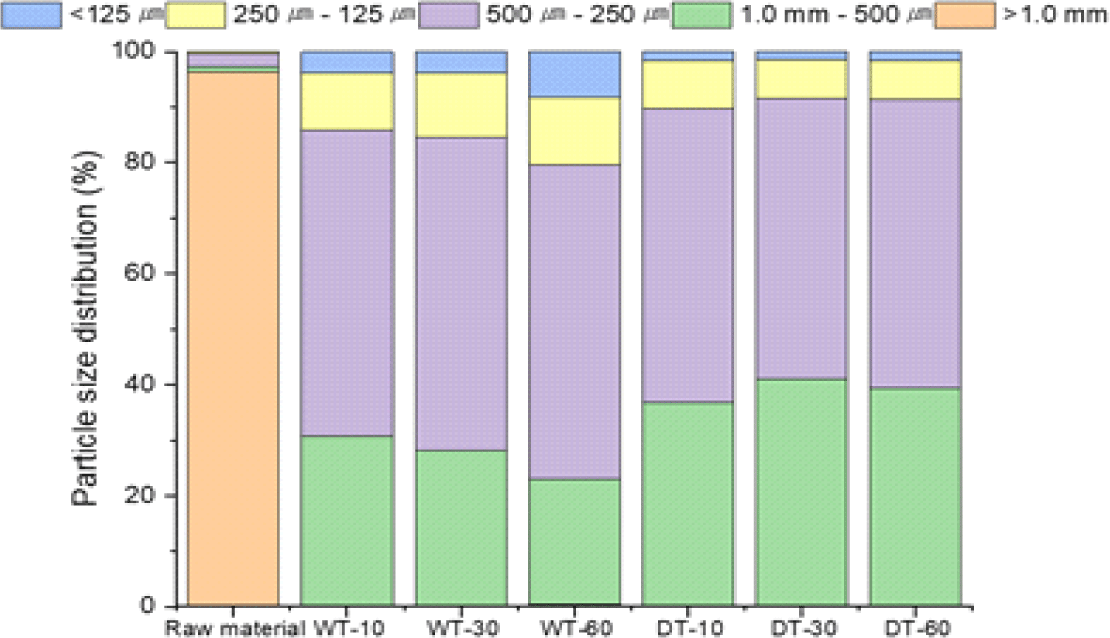
원시료와 반탄화 바이오매스의 입자크기 분포는 Fig. 5에 나타냈으며, 원시료는 1.0 mm 이상의 입자크기를 가장 많이 포함하고 있다. 반면 반탄화 바이오매스는 250 μm–1.0 mm의 입자크기를 포함하고 있다. 원시료 바이오매스와 비교하여 반탄화 바이오매스에서 미세분 함량이 높았다. 반탄화 과정에서 바이오매스 구성성분의 분해로 바이오매스 분쇄 능력이 향상되었으며, 미세분 생성에 직접적인 영향을 주었다[5]. 바이오매스 입자크기는 생분해성 플라스틱 생산을 위한 수지와 혼합에서 중요한 인자로 작용한다.
요 약
본 연구에서는 건식·습식 반탄화 바이오매스의 물리적, 화학적 특성을 분석하였다. 반탄화에 의해 주로 헤미셀룰로오스가 분해되었으며, 상대적으로 글루칸과 리그닌이 함량이 증가하였다. 분해율은 건식 반탄화(3.12%–3.83%)보다 습식 반탄화(18.25%–23.13%)에서 높았으며, 반응시간이 길어질수록 분해율이 증가하였다. 결정화도는 원시료(36.88%)와 비교하여 반탄화 바이오매스에서 높았으며 30분 동안 습식 반탄화를 수행하였을 때 가장 높은 결정화도를 나타냈다(60.97%). 열중량 분석 결과, 원시료보다 반탄화 바이오매스에서 열안정성이 우수한 것으로 나타났다. 반탄화에 의해 바이오매스 소수성 및 미세분 함량이 증가하였으며 습식 반탄화(60분)에서 가장 낮은 수분흡수를 나타냈다.






