서 론
프로바이오틱스에 대한 개념은 발효유제품과 발효식품을 이용하게 된 이후부터 시작이 되었으나, 20세기에 들어와서 과학적으로 정립이 되었다. 그중에서도 1974년 Parker는 “가축에 있어서 장내미생물의 균형에 도움을 주는 미생물과 물질”로 프로바이오틱스를 정의하였는데, 장내 미생물과 숙주의 건강이라는 개념을 Probiotics의 주된 효과로 생각하였다. 1989년 Fuller는 “장내미생물 균총을 증진시킴으로써 숙주 동물에 유익한 효과를 주는 살아있는 미생물 사료 첨가제”로 Probiotics의 개념을 보다 명확하게 정의하였다. 현재 프로바이오틱스에 대한 과학적 정의는 “유효한 수준을 투여하였을 때 숙주의 건강증진을 가져오는 살아있는 미생물”로 2002년 FAO/WHO 연합회의에서 제창한 정의를 사용하고 있다[1]. 현재까지 프로바이오틱스로 이용되는 미생물 종류로는 유산균(lactic acid bacteria)으로 알려진 여러 속(genus)들을 포함하여, 효모, 바실러스 속, 비피도박테리움 속 등을 들 수 있으며, Lactobacillus들이 이 대부분을 차지하고 있다. Lactobacillus 속은 2020년에 23개의 새로운 속으로 세분화 되었으며, 지금은 새로운 속명을 사용하고 있으니 유의해야 할 것이다[2].
최근 발병율이 급격하게 증가하고 있는 장질환은 염증성 장질환(IBD)으로 복통, 설사, 혈변, 발열, 체중감소 등 증상이 나타나며, 궤양성 대장염과 크론병이 대표적인 질환이다[3]. IBD 치료제로는 경구 복용약, 좌약, 국소 거품 등 다양한 제형으로 판매되고 있지만, 이들 약제는 치료 효과에 대한 일시적 임상 근거는 뚜렷하지만 부작용의 위험이 크다고 알려져 있어, 프로바이오틱스(probiotics)의 염증성 장 질환 예방 및 치료에 관련한 연구들이 이루어지고 있다. 유산균 및 비피도박테리아(Bifidobacterium 속)를 포함하는 프로바이오틱스는 숙주의 장관을 포함한 다양한 곳에 상주하며, 건강 증진 및 유지의 기능을 한다고 알려져 있다. 특히, 면역조절 활성은 장관 내의 다양한 질환과 연관되어 있어 프로바이오틱스의 중요성이 부각되고 있다.
본 논문은 프로바이오틱스로 이용 가능한 다양한 유산균 중에서 아직 연구가 많이 되어 있지 않은 Latilactobacillus curvatus 균주에 대한 장염증 완화 작용에 대하여 살펴보고자 한다.
본 론
프로바이오틱스가 함유된 발효유의 섭취가 염증성 장 질환 및 아토피 피부염 등 일부 자가 면역 질환의 증상을 완화시킬 수 있으며, 더 나아가 숙주의 면역 기능 관련 특정 인자들을 조절한다고 한다고 보고된 바 있다. Gupta 등[4]은 L. rhamnosus GG의 섭취가 크론병을 앓고 있는 환자의 장 투과성을 향상시켜 회복점수(clinical score)를 향상시켰다고 보고하였으며, L. rhamnosus GG와 프락토올리고당(fructooligosaccharide)의 혼합제를 항생제의 보조요법으로 함께 사용하였을 때 완화 증상을 보였다고 보고하였다[5].
또한, Lactobacillus 균주(Lactiplantibacillus plantarum, L. casei, L. acidophilus, L. delbrueckii)와 비피도박테리아 균주(B. infantis, B. breve, B. longum)가 함유된 복합 프로바이오틱스를 만성 비특이적 궤양성 대장염(ulcerative colitis) 및 크론병(Crohn’s disease) 환자에게 투여한 결과 대장염이 다소 완화된 것으로 나타났다. 다수의 연구에서 프로바이오틱스는 만성 낭염(chronic pouchitis)을 완화시키고, 염증성 장 질환의 증상을 효과적으로 완화시킬 수 있는 것으로 확인되었다[6,7].
특정 유산균은 염증 인자의 과잉 발현 억제를 통해 숙주 면역 반응에 영향을 줌으로써 대장염을 개선한다는 것이 밝혀졌는데[8–10], 인터루킨(IL)-6와 같은 사이토카인과 TNF-R1과 같은 사이토카인 수용체는 세균성 뇌수막염 이후의 선천적 면역반응 조절에 중요한 역할을 하며[11] IBD의 병인 형성에도 관여하고 있다[12]. 특히, IBD는 염증성 사이토카인 IL-6 및 TNF-α뿐만 아니라 염증 유발 효소(iNOS 및 COX-2[13])와 관련이 있는 것으로 밝혀졌다. Latilactobacillus 속은 Lactobacillus 속에서 재분류 되었는데 type species는 L. sakei 이다. 전체 게놈서열에 기초로 Latilactobacillus 속으로 재분류된 species는 L. curvatus, L. sakei, L. graminis, L. fuchuensis이며(Fig. 1), 해당과정을 통해 6탄당(hexose)을 통하여 젖산으로 대사되며 5탄당(pentose)은 Phosphoketolase 경로를 통해 젖산과 초산으로 대사된다.
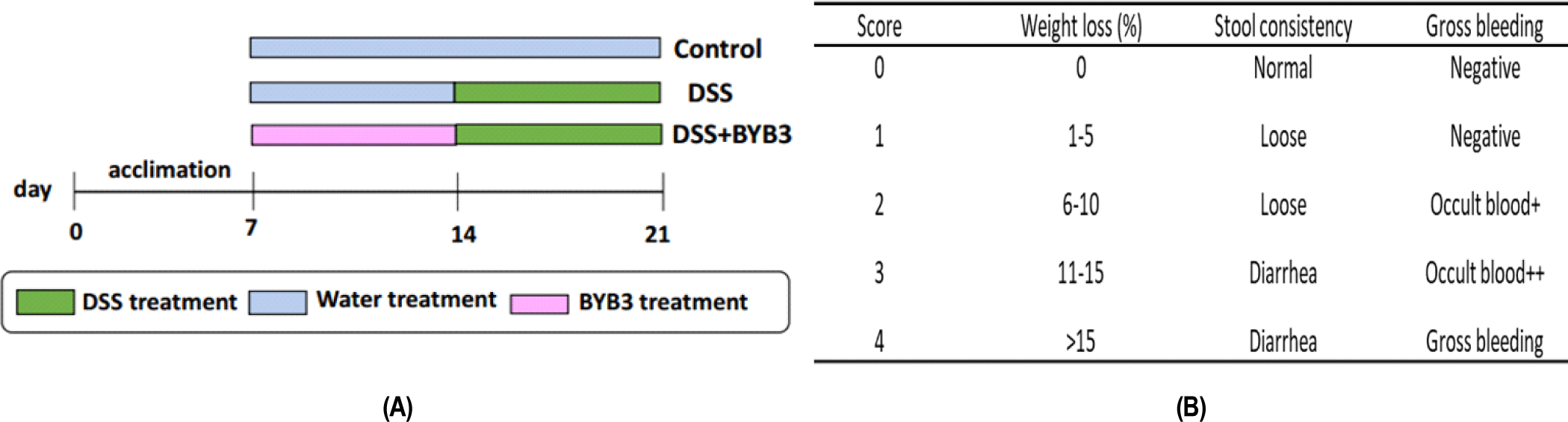
L. curvatus 균주로 장염증 평가를 한 논문은 현재까지 우리나라 연구팀에서 발표한 2편 정도이다[14,15]. Latilactobacillus curvatus WiKim38과 BYB3 균주는 모두 김치에서 분리되었으며 향후에 프로바이오틱스로서의 역할이 기대되는 유산균이다.
WiKim38은 수지상 세포에서 항염증성 사이토카인 IL-10의 생성을 유도하고 쥐에서 황산 덱스트란 나트륨 유도 대장염을 완화하는 것으로 알려져 있다. Wang et al.[14]의 최근 보고에 의하면 DSS로 대장염이 유도된 동물모델에서 Latilactobacillus curvatus BYB3의 급여는 혈중 IL-6 및 TNF-R1 수준과 질병활동지수(DAI)를 유의하게 감소시켜 거의 정상 수준으로 회복시키는 것으로 나타났다.
실험 동물을 이용한 염증성 대장질환 연구는 동물윤리법과 실험동물에 관한 법률에 근거하여 각 기관의 동물실험 윤리위원회의 승인을 거친 후 실시하는데 연구목적에 따라 다양한 방법이 사용되고 있다. 염증 유발 물질로 초산, TNBS(Trinitrobenzene sulfonic acid), PG-PS(Peptidoglycan- polysaccharide), Indomethacin, 및 DSS(Dextran sulfate sodium) 등이 사용되어 왔으며 최근에는 DSS를 가장 많이 사용한다. DSS 투여로 인한 염증유도는 1%–10% 정도를 사용하는데, 음용수에 첨가하여 투여시에는 5%–10%의 DSS를 사용한다. DSS의 분자량이 500 kDa 정도의 DSS는 대장염을 유발시키지 않기 때문에 유의해야 한다. Fig. 1은 Wang 등[14]의 연구에서 사용한 실험 설계를 나타낸 것으로 덱스트란 황산나트륨(DSS)으로 대장염 유발 마우스에 L. curvatus BYB3 투여에 대한 효능평가를 위한 동물실험을 요약한 것이다. Wang 등[14]은 생후 5주령의 암컷 C57BL/6J 마우스(Orient, Korea)를 20℃, 습도 50%, 12시간 명암주기가 유지되는 전남대학교 동물사육실에서 1주일간 예비사육한 후 사용하였다. 대조군, DSS, DSS+BYB3의 3개 그룹(n=각 6개)으로 나누어, 마우스(에 정상적인 식사와 DSS가 4% 함유된 식수를 공급하고, 실험 14–21일째의 1주일 동안 2×109CFU/mL의 L. curvatus BYB3를 경구 투여하였으며 Disease activity index(DAI)는 DAI=(체중 감소)+(지혈 점수)+(직장 출혈 점수)로 하여 평가하였다[16].
L. curvatus WiKim38의 생체내 항염증 효과는 DSS(Dextran Sodium Sulfate) 유도 대장염 마우스 모델에서 조사되었다. L. curvatus WiKim38은 LPS에 의해 유도된 것과 비교하여 BMDC에서 상당히 높은 수준의 IL-10을 유도했다. NF-γB와 ERK는 L. curvatus WiKim38에 의해 활성화되었고, 억제제 분석은 이러한 경로가 L. curvatus WiKim38에 의해 유도된 BMDC의 IL-10 생산에 필요하다는 것을 밝혔다. 생체내 실험 결과 L. curvatus WiKim38 경구 투여로 DSS 유발 대장염 마우스의 생존율이 증가하고 임상 징후가 개선된 것으로 나타났다[15].
Wang 등은 김치에서 분리한 L. curvatus BYB3 균주 투여에 따른 마우스의 대장 길이를 측정하고 대장 조직의 표피 구조와 염증 침윤을 조사하여 증상 완화를 평가한 결과, 대조군의 대장 길이(7.3±0.3 cm)가 가장 길었고, 맹장은 다른 두 그룹보다 정상적이었으며, 대변은 건강해 보였다. DSS 그룹은 평균 대장 길이(5.9±0.2 cm)가 짧고 짙은 붉은 색을 띄며 장출혈이 나타났으며, DSS+BYB3 그룹에 속한 마우스의 대장은 평균 길이(5.8±0.4 cm)가 정상보다 짧아짐이 관찰되었고 DSS+BYB3 그룹의 대장은 DSS 그룹의 대장보다 밝은 색이었다. 또한 BYB3로 처리된 대장염에 감염된 생쥐의 대장에서는 DSS 그룹에 비해 장출혈이 유의적으로 감소하였다(Fig. 2A). 체중 감소, 대변 일관성 및 출혈에 대한 DAI 종합 점수는 DSS+BYB3 그룹에서 질병 유발이 현저하게 낮아졌으며 음을 보여주었다(Fig. 2B). DSS로 유도된 마우스에서는 대조군과 비교하여 체중감소가 나타났으나, L. curvatus BYB3 투여군에서는 체중이 약간 회복하는 경향을 나타내었다(Data were not shown). 쥐의 대식세포에서 DSS 유도 염증 반응은 항염증인자 연구에 광범위하게 사용되는 생체 내 모델이다[17,18]. 체중 감소, 혈중 설사, 대장 길이 축소, 대장 출혈, 장 상피구조 파괴는 DSS 유도 대장염 마우스에서 흔히 관찰되는데[19], 이러한 연구결과는 BYB3 균주가 DSS 유도 대장염의 증상을 개선했음을 나타내는 것이다.
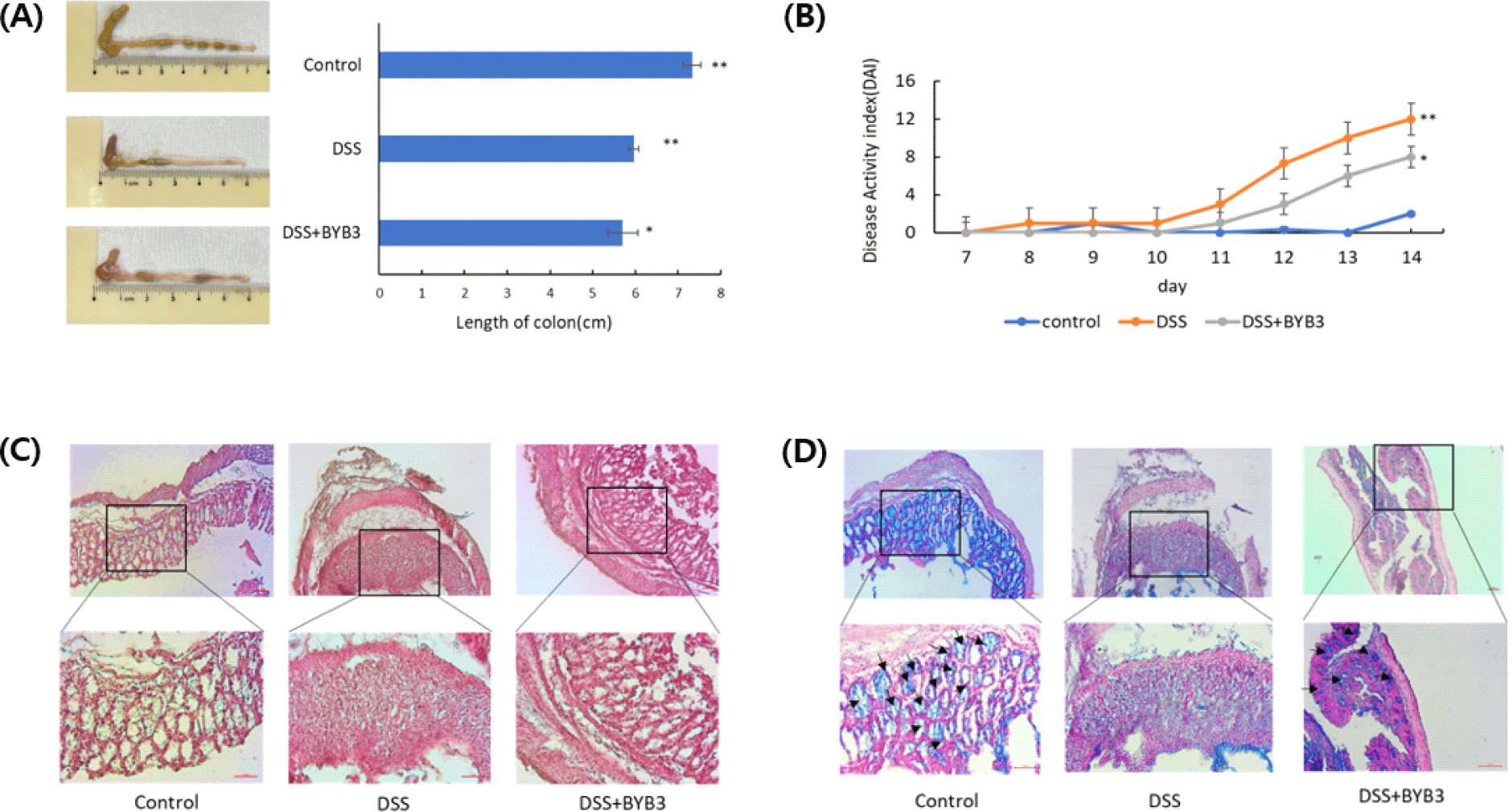
L. curvatus BYB3 투여에 따른 마우스 대장조직의 형태학적 변화를 확인하기 위해 Hematoxylin-eosin stainiong과 Alcian blue staining 사용하여 광학현미경으로 관찰하였다. 대조군에서는 점막에서 염증 침윤이 관찰되지 않은 반면, DSS로 유도된 마우스 대장 조직은 염증성 침윤과 상피세포 손상 등이 관찰되었다. L. curvatus BYB3 투여 그룹의 장세포 조직은 경미한 상피 구조 손상만이 관찰되었다(Fig. 2C). Alcian blue로 염색된 결장세포에서도 L. curvatus BYB3 투여가 점막세포층과 고블렛 세포가 거의 정상적으로 회복하는 것으로 관찰되었다. 이와 같은 결과로 L. curvatus BYB3가 장내의 뮤신 분비 고블렛 세포의 수를 증가시켜 DSS에 의한 손상으로부터 대장을 보호하였다는 것을 확인할 수 있었다(Fig. 2D). 염증은 숙주 면역체계의 보호 반응이지만 비정상적인 염증 반응은 숙주 조직에 손상을 일으킬 수 있기 때문에 항염증 작용이 있는 프로바이오틱스 또는 식물 추출물은 중요한 연구 소재가 되고 있다.
DSS로 유도된 대장염에서의 병인은 염증성 사이토카인의 비정상적인 과발현을 가지며 특히 TNF-α와 IL-6이 주요 분자로 밝혀졌는데 전염증성 사이토카인으로서 IL-6는 NF-KB를 표적으로 하여 항염증 메커니즘을 조절해 TNF-α와 같은 사이토카인의 생성을 억제한다[20]. DSS 유도 대장염과 인간 IBD에서의 IL-6의 중요성이 밝혀졌는데[21,22], L. curvatus BYB3는 대장의 TNF-R1과 IL-6의 DSS 유도 과발현을 감소시키는데 활성화된 단핵구 감소와 대식세포 침투에 의해 매개되었을 가능성이 높다[23].
Wang 등[14]은 대조구 마우스의 경우 DSS 유도로 IL-6, TNF-R1, TNF-R2, TNF-α 수치가 유의미하게 증가했으며, 전염증성 사이토카인의 발현은 L. curvatus BYB3 섭취시에 감소하였다고 보고 하였다. DSS+BYB3 그룹에서는 DSS 그룹보다 IL-6 발현이 유의미하게 감소했지만 대조군 그룹보다 높게 유지되었고 TNF-R1에서도 DSS 그룹에 비해 DSS+BYB3 그룹에서는 유의하게 감소하는 것으로 나타났다. TNF-R2 및 TNF-α 발현 수준은 DSS 그룹의 TNF-R1 발현 수준보다 낮았지만, DSS+BYB3 그룹에서는 대조군에서 관찰된 것과 유사한 수준으로 감소하였다. 대조군에 비해 iNOS 및 COX-2 mRNA의 발현은 DSS 그룹에서 유의미하게 증가되었으며, DSS+BYB3 그룹에서는 iNOS 및 COX-2의 mRNA 발현이 현저하게 감소되었다. COX-2 mRNA와 iNOS mRNA 모두 DSS 그룹의 유전자 발현에 비해 DSS+BYB3 그룹에서 낮았지만, iNOS 발현의 감소는 뚜렷하지 않았다(Data were not shown). COX-2는 다양한 유해인자에 의해 유도되며 특정 프로스타글란딘의 합성을 촉매함으로써 염증반응을 매개하는데 관여하고, 다양한 자극인자가 iNOS의 발현을 증가시켜 많은 NO를 합성하고 염증을 촉진시킨다[24,25]. COX-2와 iNOS의 유전자 발현의 감소로 대장염의 병인과 연관되어 있음을 확인하였다.
결 론
김치는 세계적으로 알려진 한국 고유의 전통 발효 식품으로 Weissella 속, Leuconostoc 속, Pediococcus 속, 및 Lactobacillus 속 등의 유산균이 김치 발효에 관여한다. L. curvatus는 아직까지 김치 발효 과정 중의 역할에 대해서는 연구된 바가 없지만 김치를 비롯한 발효식품에서 흔히 분리되는 유산균이다. 유제품에서는 NSLAB(non starter lactic acid bacteria; 비스타터 유산균)로 발효 초기단계에 관여하지 않고 숙성과 같이 유제품(치즈) 발효의 2차단계에 관여하는 유산균이다. 김치의 경우에도 숙성단계에서 김치발효에 관여하는 유산균으로 생각되고 있다.
L. curvatus는 1903년 Bacterium curvatus로 최초로 보고 되었으며, 그 이후 1965년에 Lactobacillus curvatus로 재명명된 이후 최근에 Latilactobacillus 속으로 재분류 되었다.
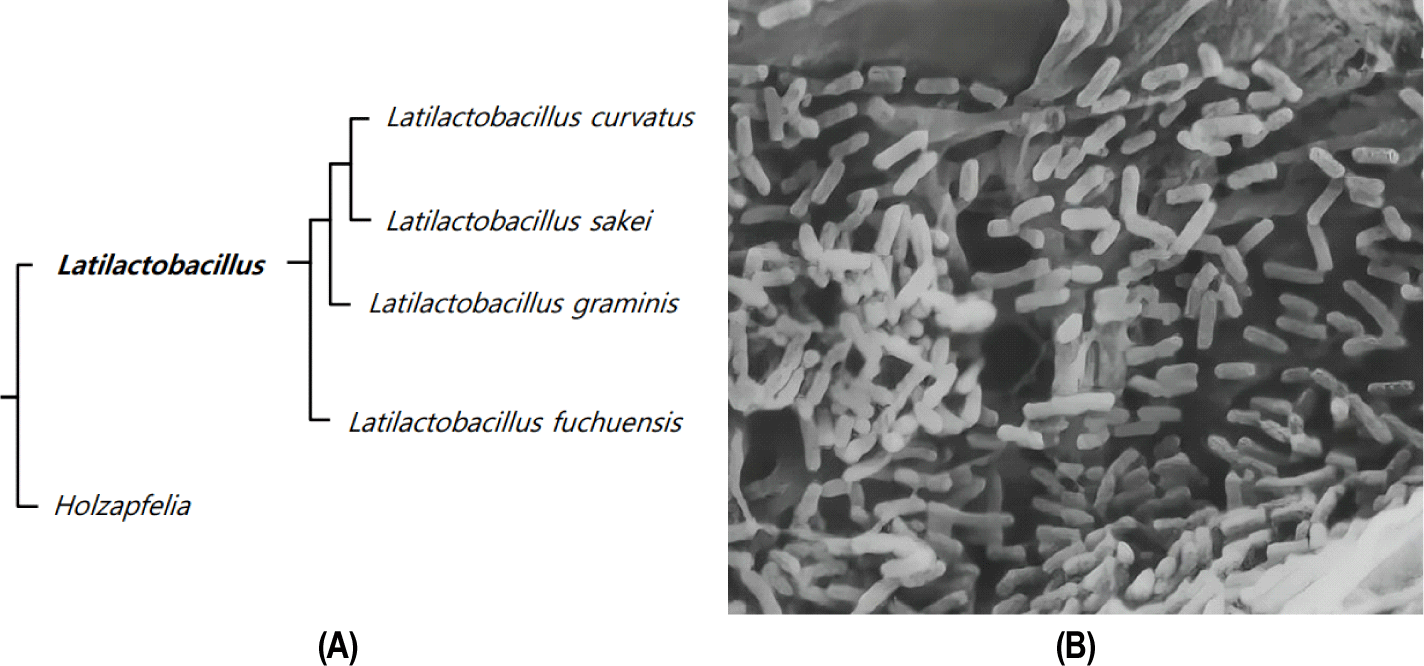
Fig. 3A에서 보는 바와 같이, 계통 발생학적으로 L. curvatus는 Latilactobacillus sakei와 유전적으로 유사한 특성이 있다. MRS 한천 배지에서 L. curvatus 집락은 유백색(직경 1–2 mm)으로 불투명하고 볼록하여 전형적인 Lactobacillus 속 유산균의 집락형태를 가지고 있다. 그람 양성균으로 길이가 약 1–2 μm을 가진 구부러진 모양의 짧은 막대형으로 나타나며, 간혹 쌍 또는 짧은 사슬로 존재한다(Fig. 3B). L. curvatus는 발효 육제품에서 분리되며, 유제품(우유와 치즈), 김치와 Sauerkraut와 같은 발효 채소 제품에서도 흔히 분리되기 때문에 이를 섭취하는 인간의 분변에서도 존재한다.
최근 Jo 등[15]은 배추김치에서 L. curvatus Wikim38을 분리하였으며 이 균주가 DSS로 대장염이 유도된 동물모델에서 장 염증에 대한 보호 효과가 있다는 것을 밝혀냈다. Wang 등[14]도 광주지역 숙성김치에서 분리한 L. curvatus BYB3에서 장염증 완화 및 장보호 기능이 있음을 확인하였다.
결론적으로 발효식품인 김치에서 분리된 L. curvatus는 장 상피조직의 손상을 유발하는 염증성 사이토카인 및 수용체의 발현을 억제함으로써 마우스의 대장염을 완화시키는 효과가 있으며 L. curvatus가 염증성 사이토카인의 과발현으로 인한 염증을 줄임으로써 대장염을 개선한다는 것을 시사한다.






