서 론
화석연료의 사용 증가는 에너지 자원고갈을 야기시켜 이를 대체할 수 있는 대체에너지 개발이 요구된다. 바이오에탄올은 친환경적인 대체연료 중 하나로 목질계 바이오매스로부터 생산 가능하다. 목질계 바이오매스로부터 바이오에탄올 생산 효율을 높이기 위해서는 셀룰로오스 및 헤미셀룰로오스와 결합되어 있는 리그닌의 제거가 요구된다. 리그닌은 효소가수분해를 저해하는 중요한 인자로 전처리 단계에서 효율적인 제거가 필요하다(1).
표고버섯(Lentinus edodes)은 전 세계적으로 섭취되는 3가지 식용 버섯 중 하나이며, 이는 리그닌 분해 효소를 분비하므로 목질계 바이오매스의 리그닌 분해를 유도할 수 있다(2-3). 표고버섯 재배 후 생산된 폐배지는 매년 그 발생량이 증가하고 있으며 대부분 고형 폐기물로 버려지고 있어 환경 문제를 유발한다. 표고버섯 폐배지는 L. edodes에 의한 리그닌 분해로 바이오에탄올 생산에 사용되는 목질계 바이오매스와 비교하여 낮은 함량의 리그닌을 포함하고 있다. 뿐만 아니라 18~62%의 높은 셀룰로오스를 함유하고 있어 발효가능한 당 생산을 위한 원료로 활용가능성이 높다(4). 목질계 바이오매스로부터 바이오에탄올 생산 과정에 있어 발효가능한 당 생산의 효율을 높이기 위해서는 전처리 과정이 필수적이다. 옥살산은 황산에 비해 취급에 있어 안전하고 전처리 과정에서 유해한 가스를 배출시키지 않아 친환경적인 전처리 공정을 유도할 수 있다(5-6).
본 연구는 표고버섯 폐배지로부터 바이오에탄올을 생산하기 위한 옥살산 전처리 반응시간 및 산촉매 농도에 따른 최적 전처리 조건을 탐색하고자 수행되었다.
재료 및 방법
전라남도 산림자원연구소에서 제공받은 표고버섯 (Lentinula edodes) 폐배지를 공시재료로 사용하였다. 표고버섯 배지의 초기 구성성분은 참나무 톱밥 ±80%, 미강(쌀겨) ±20%, 칼슘(친환경 소재) 0.05%, 탄산칼슘 0.03%였다. 시료는 전처리를 수행하기 위해 20~80 mesh로 분쇄하여 제조하였으며, 4°C에서 보관하였다.
전처리는 600 mL의 반응기(Model EMV-HT/HP600, E.M.S. Korea)에서 전건시료 25 g과 산촉매 용액을 고액비 1:8로 투입하여 반응온도 160°C, 교반속도 150 rpm로 수행하였다. 전처리의 산농도와 반응시간은 Table 1과 같다. 반응시간 및 온도, pH의 영향을 통합하여 단일변수로 나타내는 combined severity factor (CSF)를 이용하여 전처리 정도를 나타냈다(7). 전처리 반응 종료 후 반응기를 얼음물에 10분간 급랭시켰다. 반응 슬러리는 액상가수분해산물과 고형바이오매스로 분리하여 4°C에서 냉장 보관하였다.
a Combined severity factor (CSF) = log{t × exp[(TH−TR)/14.75]}−pH (t is the reaction time for the pretreatment in minutes, TH is the reaction temperature in °C, and TR is the reference temperature, most often 100°C(8).
액상가수분해산물에 포함된 발효가능한 당(글루코스, 자일로스) 및 발효저해물질[furfural, acetic acid, 5-hydroxymethylfurfural (HMF), formic acid]의 농도는 HPLC (Waters e2695, USA)로 Aminex 87H column (300×7.8 mm, BIO-RAD)과 Refractive index detector (Waters 2414, USA)를 이용하여 분석하였다. 이동상은 0.6 mL/min으로 5 mM H2SO4를 사용하였으며, 55분 동안 분석하였다. 액상가수분해산물에 포함된 리그닌 분해산물인 total phenolic compounds (TPC)의 함량은 Folin-Ciocalteu’s reagent를 이용하여 측정하였다(9).
표고버섯 폐배지 원시료와 CSF에 따라 전처리된 바이오매스의 구성성분은 NREL 방법(Laboratory Analytical Procedure-Determination of structural carbohydrates and lignin in biomass)으로 분석하였다(10).
표고버섯 폐배지에 함유된 5탄당과 6탄당을 동시에 발효가능한 Pichia stipitis CBS 6054를 공시균주로 사용하였다. P. stipitis CBS 6054는 액체배지(yeast extract 10 g/L, peptone 20 g/L, glucose 20 g/L)에 접종하여 30°C, 150 rpm의 배양기에서 24시간 동안 선 배양한 후 발효에 사용하였다. 전처리 후 생성된 액상가수분해산물의 pH는 NaOH를 사용하여 pH 5.5로 조절하였다. pH가 조절된 액상가수분해산물에 KH2PO4 1 g/L, MgSO4 · 7H2O 0.5 g/L, Yeast Extract 5 g/L, urea 5 g/L를 각각 첨가하여, 121°C에서 15분간 멸균하였다. 배양된 P. stipitis CBS 6054 2 g (dry cell weight)/L를 멸균된 액상가수분해산물에 첨가 후 30°C, 150 rpm 조건에서 96시간 동안 발효를 수행하였으며, 24시간 간격으로 배양액을 채취하였다. 단당류(글루코스, 자일로스) 및 에탄올 분석은 HPLC를 이용하여 수행하였다.
전처리된 고형바이오매스 5 g(전건기준)과 50 mM sodium citrate buffer (pH 6.0)를 고액비 1:10으로 삼각플라스크에 투입하였다. 반응온도 30°C에서 교반속도 150 rpm으로 shaking incubator에 1시간 동안 배양한 후, NaOH를 이용하여 pH 6.0으로 조절하였다. 그 후 각각의 삼각플라스크에 영양소(KH2PO4 1 g/L, MgSO4 · 7H2O 0.5 g/L, Yeast Extract 5 g/L, urea 5 g/L)를 첨가하여 121°C에서 15분간 멸균하였다. 효소 mixture와 배양된 P. stipitis를 순서대로 첨가하였다. 효소 mixture는 cellulase (Celluclast 1.5L 17.5 FPU/g)와 β-glucosidase (12.5 CBU/g)로 구성되었다. 동시 당화발효는 30°C, 150 rpm 조건에서 96시간 동안 수행하였으며, 단당류(글루코스, 자일로스) 및 에탄올 분석은 HPLC를 이용하였다.
결과 및 고찰
Table 2는 CSF에 따라 옥살산 전처리 후 액상가수분해산물에 포함된 구성성분 분석 결과이다. 액상가수분해산물에는 주로 발효가능한 당인 글루코스(0.78~9.26 g/L)와 자일로스(0.28~6.37 g/L)가 검출되었다. 가장 많은 발효가능한 당은 13.18 g/L로 CSF 1.59에서 나타났다. 일반적인 산 전처리 효과와는 다르게 액상가수분해산물에서 글루코스의 함량이 다소 높게 검출되었는데, 이것은 버섯 배지 구성성분 중 미강에 의한 것으로 판단된다. 옥살산 전처리에 의해 헤미셀룰로오스가 선택적으로 분해되어 자일로스의 함량이 증가하게 되고, 전처리 정도가 증가할수록 셀룰로오스의 분해가 시작되어 글루코스의 함량 또한 증가하였다(11). CSF 값이 증가할수록 단당(글루코스 및 자일로스)의 농도는 증가하였으나, CSF 1.89 이상에서 감소하였다. CSF 값의 증가는 바이오매스의 분해를 촉진시키므로 글루코스와 자일로스가 분해산물인 HMF와 furfural로 각각 변환된 것으로 판단된다(12-13). 액상가수분해산물에 포함된 HMF (0.26~1.42 g/L), furfural (0.29~2.27 g/L), formic acid (1.11~2.23 g/L), acetic acid (1.21~3.80 g/L), TPC (1.70~4.76 g/L)는 발효공정에 있어 일정량 이상 함유할 시 에탄올 생산에 부정적인 영향을 주는 발효저해물질로 알려져 있다(14). Formic acid는 HMF와 furfural로부터 생성되 며 acetic acid는 헤미셀룰로오스에 존재하는 아세틸기의 가수분해에 의해 생성되는 분해산물이다(15). 옥살산 전처리는 부분적인 탈리그닌화를 유도하여 모든 전처리 조건에서 리그닌 분해산물인 TPC가 검출되었다. 이러한 발효저해물질들의 함량은 CSF 값 이 높아질수록 증가하는 경향을 나타냈다.
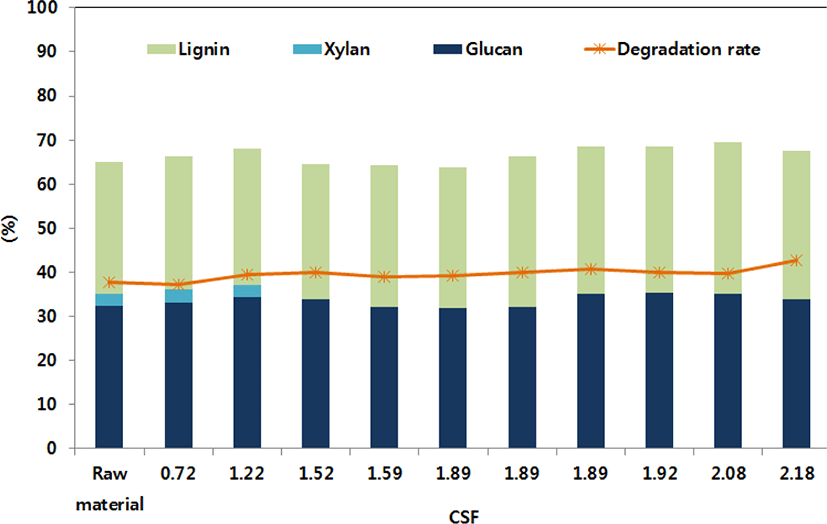
옥살산 전처리 후 고형바이오매스의 구성성분 및 분해율 측정 결과는 Fig. 1과 같다. 원시료는 글루칸 30.34±0.23%, 자일란 9.37±0.60%, 리그닌 19.94±0.28%, 회분 10.63±0.23%, 추출물 7.07±0.32%로 구성되었 다. 전처리에 의한 바이오매스의 분해율은 CSF 값이 증가할수록 증가하였으며 CSF 1.22에서 37.56%로 가장 낮은 분해율을 나타냈으며, CSF 2.29에서 42.61%의 가장 높은 분해율을 나타냈다. 옥살산 전처리에 의한 헤미셀룰로오스의 선택적인 분해로 자일란(0.00~2.99%)은 CSF 값이 증가할수록 점차 감소되어 CSF 1.52 이상에서는 완전히 제거되었으며, 자일란의 감소는 원시료와 비교하여 글루칸(31.69~35.28%)과 리그닌(29.74~34.49%) 함량을 상대적으로 증가시켰다. 분해율이 높아질수록 액상가수분해산물에 포함된 발효저해물질의 농도가 증가한 것을 확인하였다. 이것은 전처리 정도가 증가할수록 바이오매스 구성당 및 일부 리그닌의 분해가 촉진된 것을 의미한다. 이는 기존에 보고된 전형적인 옥살산 전처리의 연구결과와 일치하였다(6).
액상가수분해산물로부터 생산된 에탄올은 Table 3에 나타냈다. 모든 CSF 조건에서 에탄올(0.21~2.79 g/L)이 생성되었다. CSF 값이 증가함에 따라 에탄올생산량은 증가하였으며, CSF 1.92 이상의 조건에서 감 소하였다. 최대 에탄올 생산량(2.79 g/L)은 CSF 1.89 조건에서 72시간 경과 후 확인되었으며, 에탄올 수율 및 이론적 에탄올 수율은 각각 0.27 g/g, 52.83%로 나타났다. CSF 1.89 조건에서 발효가능한 당으로부터 시간당 생산되는 에탄올 양은 0.04 g/L· h였다. 에탄올 생산 속도는 낮았으며, 이는 액상가수분해산물 내에 발효를 억제시키는 저해물질이 일정량 이상 함유되어 있기 때문으로 판단된다. 일반적으로 5 g/L 이상의 acetic acid, 2.5 g/L 이상의 furfural, 3 g/L 이상의 HMF, 2 g/L 이상의 TPC는 발효과정에서 효모와 효소의 활성을 저해시킨다고 보고되었다(16-18). 대부분의 전처리 조건에서 일정량 이상의 발효저해물질을 함유하고 있으므로 발효과정에 부정적인 영향을 미친 것으로 판단된다. 따라서 CSF 1.59 이상의 조건에서 에탄올 발효과정 종료 후에도 에탄올로 변환되지 못한 당(5 g/L 이상)이 검출되었으며, 대부분의 CSF 조건에서 낮은 에탄올 생산량을 나타냈다. 바이오매스 활용을 극대화하기 위해서는 바이오에탄올과 furfural 등을 이용한 바이오기반 화학물질의 통합생산이 이루어져야 할 것이며, 경제적인 측면에서 긍정적인 효과를 나타낼 것이다.
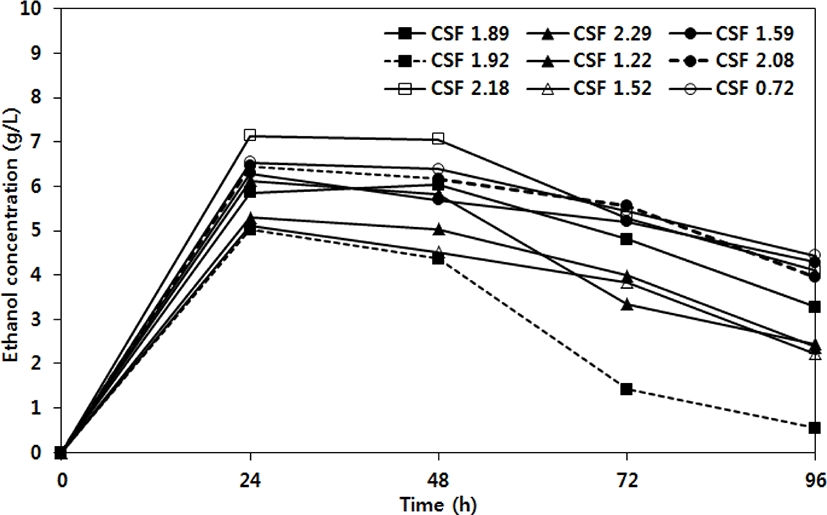
Fig. 2는 옥살산 전처리 고형바이오매스의 동시당 화발효 공정에서 에탄올 생산량을 나타낸 것이다. 대부분의 CSF 조건에서 24 시간 이내에 가장 높은 에탄올 생산(5.02~7.13 g/L)을 나타냈다. 최대 에탄올 농도는 CSF 2.18 조건에서 나타났으며, 에탄올 수율은 35.86%였다. 동시당화발효 24시간 이후 에탄올 함량이 감소하였다. 이는 효모의 생장유지를 위해 에탄올이 에너지원으로 소비되어 감소한 것으로 판단된다(19). 표고버섯 폐배지의 옥살산 전처리로부터 생산된 총 에탄올 함량을 Table 4에 나타냈다. 최대 에탄올 생산량은 CSF 1.89에서 8.64 g/L로 나타났으며, CSF 값에 따른 큰 차이를 나타내지 않았다.
요 약
본 연구에서는 표고버섯 폐배지로부터 바이오에탄올을 생산하기 위해 CSF에 따른 옥살산 전처리를 수행하였다. 액상가수분해산물에는 주로 글루코스를 포함하고 있었다. 분해율은 CSF 값이 높아짐에 따라 증가하였다. 최대 에탄올 생산량은 2.79 g/L로 CSF 1.89 (30 min, 82 mM) 조건에서 72시간 발효 후 얻어졌다. CSF 값이 증가할수록 액상가수분해산물 내에 존재하는 발효저해물질의 함량이 증가하여 발효를 저해하는 것으로 나타났다. 전처리된 바이오매스를 동시당화발효에 사용했을 때 가장 높은 에탄올 수율은 35.86%로 CSF 2.18 (58 min, 82 mM) 조건에서 나타났다. 실험의 조건들 중 액상가수분해산물과 고형바이오매스에서 가장 높은 농도의 에탄올을 얻을 수 있는 최적의 전처리 조건은 CSF 1.89 (30 min, 82 mM)로 나타났으며, 최종적으로 8.64 g/L의 바이오에탄올을 생산했다.






