서론
광음향 영상법은 표지된 또는 표지되지 않은 세포에서 특정 물질을 검출해 내는 방법으로 도입되었다(1). 광음향 영상법은 광학적으로 높은 대비를 가지는 물질, 헤모글로빈 그리고 혈관을 영상화하는데 유용하게 이용되고 있다. 이외 다른 물질 또는 조직을 광음향법으로 영상화하기 위해 대상물질의 대비를 증폭시키기 위한 나노입자 또는 염색시약이 개발되어 있는데 이들 나노입자 또는 염색시약 자체가 추적물질이 되기도 한다(2).
금 나노입자는 표면 플라스몬 공명(surface plasmon resonance, SPR)에 의해 특정 빛을 흡수하여 광음향적으로 높은 대비를 나타낼 수 있는 성질을 가졌다. 추적자로써 금 나노입자의 장점은 첫째, 금은 화학적으로 비활성이고, 생물학적으로 무독성의 성질을 가졌다는 점이다. 금이 독성을 나타낸다는 보고서는 매우 드물다(3). 두 번째, 금 나노입자는 그 크기와 형태를 변화시켜 흡광에 필요한 빛의 파장에 변화를 줄 수 있다. 예를 들어 헤모글로빈의 흡광 파장을 피해 금 나노입자만을 들뜨게 하기 위해 적외선 영역의 빛 까지도 이용이 가능하다(4,5). 세 번째, 금 나노입자의 표면은 생체분자들과 높은 친화성을 가지고 있어서 기능성 분자를 부착시켜 이용하기에 유리하다(6).
한편, 최근의 연구결과에 의하면 금 나노입자는 광열반응에 의해 입자 주위로 일시적으로 나노버블을 생성시키고 이는 광음향효과를 증폭시킨다는 것이 알려졌다(7). 이 나노버블의 효과는 많은 논문에서 그 성질이 밝혀져 있고(8-14), 이를 이용한 화학방사선요법이 제시되는 등 그 유용성이 확인되고 있다(15,16). 또한 최근의 논문을 통해 광음향법이 식물의 잎에서도 적용 가능하며, 광열반응을 이용해 식물 잎의 온도를 상승시킬 수 있다는 결과도 보고되었다(17).
광음향법을 이용해 식물잎에서 나노입자를 검출한 경우는 탄소나노튜브를 토마토 잎에서 검출한 경우가 보고되어 있다(18). 하지만 탄소나노튜브는 대체로 금속 나노입자에 비해 크기가 크고(10~ 35 nm ⨯ 6 μm), 토마토 잎 내에서 클러스터를 형성한 형태를 검출했다는 점에서 금 나노입자의 검출과 기술적인 차이를 보인다. 본 연구에서는 앞선 연구에서 밝힌 금 나노입자 검출법을 이용해 애기장대 잎에서 금 나노입자의 시간별 위치를 검출하여 입자의 운동성을 파악하고 나노입자의 식물체 내에서의 대사과정을 예측하고자 하였다.
재료 및 방법
애기장대(Arabidopsis thaliana, Col-0)는 흙에서 23oC, 낮/밤을 16 hr/8 hr, 100 μmol/m2s의 광을 조사하는 조건의 생장상에서 배양하였다. 4주 동안 배양한 애기장대에서 1 cm 정도 크기로 자란 7~9번째 잎을 실험에 이용하였다.
60 nm 금 나노입자는 접합된 표면분자가 없는 형태로 구연산염으로 안정화 시킨 형태의 것을 구매하여 사용하였다(15709, Ted Pella Inc., Redding, CA, USA). 고온 멸균한 배지에 1 ppm(4.8 ⨯ 108 GNP/mL) 농도로 추가하였고, 떼어낸 애기장대 잎에 25 μmole/m2s 의 광량을 나노입자를 처리하는 동안 조사하였고 23oC의 온도를 유지하였다.
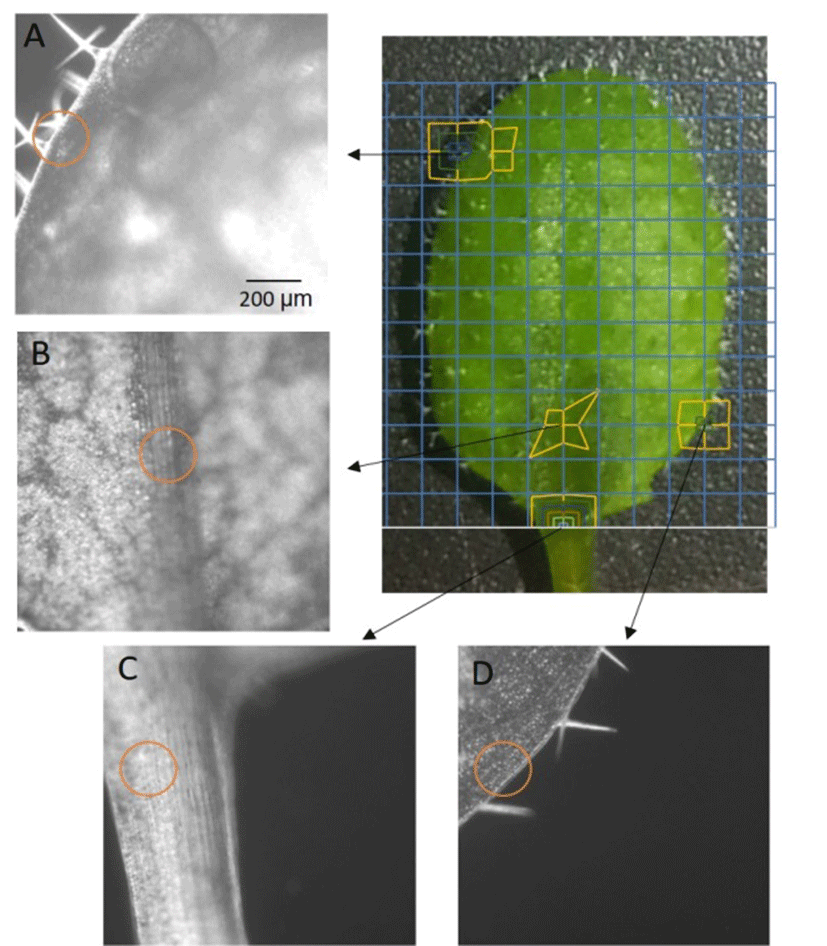
금 나노입자의 검출은 Koo 등(17)에서 밝힌 방법을 따랐다. 532 nm의 녹색 레이저를 20 ps 펄스(140~281 mJ/cm2에 해당)로 조사하였고 조사범위는 직경 200 nm 의 원형이었다. 가로세로 상하로 1 mm 간격으로 이동하며 레이저를 조사하였고 이는 전체 잎 면적의 약 12.5%를 덮는 면적이다. 레이저를 조사했을 때 발생하는 음향 신호를 초음파 검출기(XMS-30, 10 MHz, Olympus NDT Inc, Waltham, MA, USA)를 이용하여 검출하였다. 이와 같은 검출 조건은 앞선 실험에서 밝혔듯 금 나노입자의 표면 플라스마에 의해 생성되는 광음향 신호가 나노버블 생성으로 인해 증폭되어 해당 소리 신호를 높은 강도로 측정하는 방법이며, 애기장대의 잎에서 충분한 검출능력을 보여주었다(17). 무처리 잎에서 검출되는 배경 신호를 제외한 유의한 강도의 신호만을 수집하여 도표에 표시하였다. 검출되는 신호강도는 등고선의 수와 색으로 구분하여 표시하였다. 현미경 수준에서 나노입자 위치 추적을 위해 나노입자가 검출된 영역의 현미경 이미지를 얻고 그 이미지에서 레이저가 조사되는 영역을 표시하였다(Fig. 2 orange circle).
결과 및 고찰
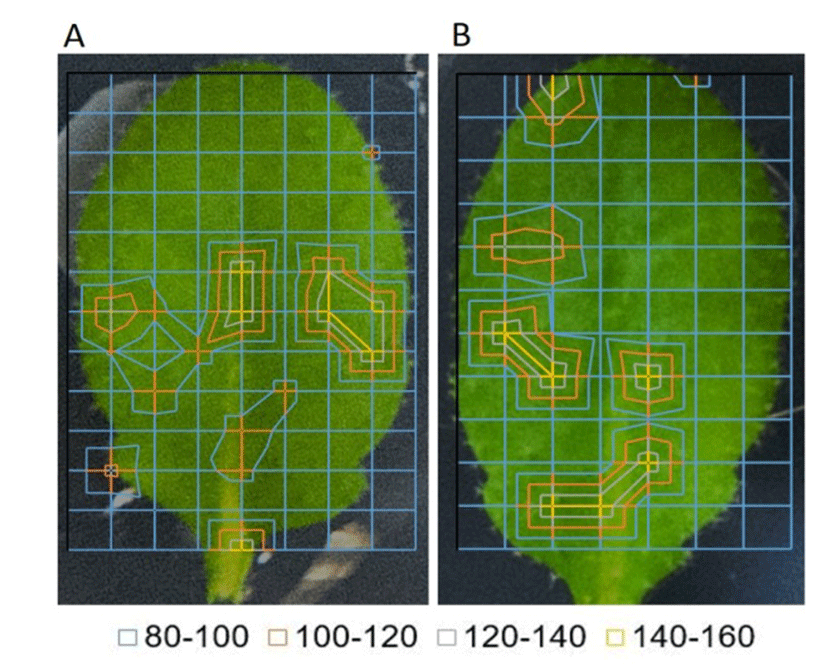
길이 1 cm 크기의 애기장대 잎의 잎자루를 잘라 60 nm 금 나노입자 1 ppm(4.8 ⨯ 108 GNP/mL)을 잎자루를 통해 주입하여 2시간, 4시간 후 금 나노입자의 분포를 광음향효과를 이용하여 관측하였다. 금 나노입자 처리 2시간 후 금 나노입자는 방사선 모양으로 잎 전체에 퍼져가는 모습을 보이고, 잎자루에서부터 최대 7 mm 위치까지 도달하였다(Fig. 1A). 4시간 후 검출 결과에서는 나노입자가 잎의 가장자리 부위까지 도달한 모습을 보였다(Fig. 1B). 즉 나노입자는 본 실험의 조건에서 애기장대 잎에서 약 3.5 mm/hr 의 속도를 가진다는 결과를 얻었다. 식물체내에서 나노입자의 운동성은 앞선 보고에 따르면 음으로 하전 된 5 nm 입자의 경우 30~60 mm/hr(PAA-EG coat), 양으로 하전 된 5 nm 입자의 경우 18~30 mm/hr(PEI coat)의 이동속도를 보였다(19). 본 실험에서 사용된 금 나노입자는 60 nm의 표면분자가 접합되지 않은 형태로 식물체 내에서 하전 되지 않은 상태로 이동할 것으로 예상된다. 금 나노입자가 이전의 결과와 비교해 느린 이동속도를 보이는 것은 60 nm 크기의 입자는 잎맥을 이동하기에 방해되는 크기이거나, 또는 입자가 전하를 띄지 않았을 때 식물체 내에서 이동이 용이하지 않을 수 있다는 점을 시사한다. 한 가지 또 다른 중요한 요인으로 잎에서보다 잎자루에서 수압이 크게 작용한다는 점도 들 수 있을 것이다. 본 실험을 통해 나노입자를 식물체 내에서 용이하게 이동시키기 위해서는 60 nm 보다 작은 크기의 나노입자를 이용하고 표면에 적절한 분자를 부착시켜 하전 된 형태를 만드는 것이 유리하다는 결과를 얻을 수 있다.
60 nm 금 나노입자의 24시간 후 위치를 광음향 방법으로 확인하고 나노입자가 검출된 위치를 현미경 수준에서 관찰하였다(Fig. 2). 나노입자는 주로 잎의 관 조직인 잎맥(Fig. 2B and C), 잎의 가장자리 부위(Fig. 2D) 또는 잎의 가장자리에 존재하는 배수조직(hydathode)에서 관측이 되었다(Fig. 2A). 나노입자를 처리한 후 충분한 시간이 지난 후 관찰된 결과로 가정했을 때, 이 결과는 금 나노입자가 잎에서 잎맥의 체관을 통해 또는 잎의 배수조직을 통해 잎 밖으로 배출된다고 예측할 수 있고, 잎에서 수분이 이동하는 경로와 유사하다는 것을 보여주고 있다. 또한 이 결과를 바탕으로 전하를 가지지 않는 60 nm 금 나노입자는 식물체내에 축적되지 못하는 성질이고, 세포내로 침투하지도 못한다는 결론에 도달하였다. 앞선 연구에서 음전하를 가진 5 nm 크기의 형광 나노입자는 투과보다 체관을 따라 빠르게 이동하고 배출되는 이동형태를 가졌고, 양전하를 가지는 5 nm 크기의 형광 나노입자는 이동속도는 느리지만 강한 세포 투과력으로 인해 세포내에 축적되고 따라서 느린 배출 속도를 보인다(19).
본 연구에서 얻은 결과들을 바탕으로 나노입자의 식물체 내에서 이동 특성을 몇 가지를 도출할 수 있다. 나노입자의 식물체 내 잎에서의 이동은 입자의 크기, 입자의 표면에 부착된 분자의 전하의 종류에 영향을 받으며 크기가 60 nm에 이르고, 하전 되지 않은 입자의 경우 식물 세포내로 침투하거나 잎의 조직에 축적되기 어렵다. 식물체 내에서 나노입자를 특정 목표 지점으로 이동시키거나 특정 조직에서 원하는 효과를 발휘하기 위한 나노입자를 제작할 때 이러한 결과가 유용한 참고사항이 될 것이다.






